
��֪��Ӧ��2SO2(g)��O2(g)  2SO3(g)����H��0��ij�¶��£���2 mol SO2��1 mol O2����10 L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����
2SO3(g)����H��0��ij�¶��£���2 mol SO2��1 mol O2����10 L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����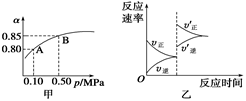
| A����ͼ��֪��A��SO2��ƽ��Ũ��Ϊ0.4 mol/L |
| B����ͼ��֪��B��SO2��O2��SO3��ƽ��Ũ��֮��Ϊ2��1��2 |
| C����ƽ�����С�����ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ |
| D��ѹǿΪ0.50 MPaʱ��ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ����T2��T1 |
C
�������������A��ͼ��A��SO2��ת����Ϊ0.80����SO2��ƽ��Ũ��Ϊ��2mol/10L(1-0.80)=0.04mol?L?1������B��ͼ��B��SO2��ת����Ϊ0.85��ת��Ũ��Ϊ��0.2mol/L��0.85=0.17mol?L?1,����
2SO2(g)��O2(g)  2SO3(g)��
2SO3(g)��
��ʼŨ�ȣ�mol?L?1�� 0.2 0.1 0
ת��Ũ�ȣ�mol?L?1�� 0.17 0.085 0.17
ƽ��Ũ�ȣ�mol?L?1�� 0.03 0.015 0.17
SO2��O2��SO3��ƽ��Ũ��֮��Ϊ��6��3��34������C����С�����ݻ���ѹǿ����ƽ�������ƶ�����ȷ��D����ͼ��T1��Ӧ���ʴ�T1>T2������
���㣺���⿼�������Է�Ӧ���ʺͻ�ѧƽ���Ӱ�졢���ڻ�ѧƽ��ļ��㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��2 L�ܱ������з�����Ӧ4A(s)��3B(g)=2C(g)��D(g)����2 min��B�����ʵ�������0.6 mol�����жԸ÷�Ӧ���ʱ�ʾ��ȷ����
A����2 minĩ�ķ�Ӧ���ʣ�v (B)��0.3 mol��L-1��min-1
B����A��ʾ�ķ�Ӧ����Ϊ��v (A)��0.4 mol��L-1��min-1
C����D��ʾ��ƽ����Ӧ����Ϊ��v (D)�� 0.05 mol��L-1��min-1
D���ֱ���B��C��ʾ�ķ�Ӧ�������ֵΪ2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
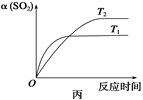
��ͼ��ʾ���߱�ʾ��������һ��ʱ��Ӧ2NO��g��+O2��g�� 2NO2��g�� ��H��0��NO��ת�������¶ȵĹ�ϵ���ߣ�ͼ�б���a��b��c��d�ĵ㣬���б�ʾδ��ƽ��״̬��V(��)��V(��)�ĵ���
2NO2��g�� ��H��0��NO��ת�������¶ȵĹ�ϵ���ߣ�ͼ�б���a��b��c��d�ĵ㣬���б�ʾδ��ƽ��״̬��V(��)��V(��)�ĵ���
| A��a�� | B��b�� | C��c �� | D��d�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ͬ�ݻ����ĸ��ܱ������н���ͬ���Ŀ��淴Ӧ��2X��g����Y��g��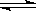 3W��g����2Z��g����ʼʱ�ĸ�������װX��Y�����ֱ�Ϊ���ף�X��2mol��Y��1mol�� �ң�X��1mol��Y��1mol������X��2mol��Y��2mol�� ����X��1mol��Y��2mol������ͬ�¶��£�����ƽ��ʱ��X��Y��ת���ʴ�С��ϵΪ
3W��g����2Z��g����ʼʱ�ĸ�������װX��Y�����ֱ�Ϊ���ף�X��2mol��Y��1mol�� �ң�X��1mol��Y��1mol������X��2mol��Y��2mol�� ����X��1mol��Y��2mol������ͬ�¶��£�����ƽ��ʱ��X��Y��ת���ʴ�С��ϵΪ
| A��X��ת����Ϊ���ף������ң��� | B��X��ת����Ϊ���ף��ң������� |
| C��Y��ת����Ϊ���ף������ң��� | D��Y��ת����Ϊ�������ң������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ���̶�������ܱ������У�����2mol A��1mol B������Ӧ��2A(g)+B(g) 3C(g)+D(g)���ﵽƽ��ʱ��C��Ũ��ΪW mol/L����ά������������¶Ȳ��䣬���������ַ����ı���ʼ���ʣ��ﵽƽ���C��Ũ����ΪWmol/L����
3C(g)+D(g)���ﵽƽ��ʱ��C��Ũ��ΪW mol/L����ά������������¶Ȳ��䣬���������ַ����ı���ʼ���ʣ��ﵽƽ���C��Ũ����ΪWmol/L����
| A��4molA+2molB | B��2molA+1molB+3molC+1molD |
| C��3molC+1molD+1molB | D��3molC+1molD |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�������£������ܱ������н��еĿ��淴Ӧ��
 2SO3��g��������˵������ȷ����
2SO3��g��������˵������ȷ����
| A���ı䷴Ӧ�������Ըı�÷�Ӧ���� |
| B���ﵽƽ���SO3��SO2��O2���ܱ������й��� |
| C���ﵽƽ���Ӧֹͣ�������淴Ӧ���ʶ������� |
| D��SO3��SO2��O2��Ũ�ȱ��ֲ��䣬˵���ÿ��淴Ӧ�ﵽ��ƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
700��ʱ�����ݻ�Ϊ2 L���ܱ������з�����ӦCO(g) + H2O(g) CO2(g) + H2(g)���������ݼ��±�������t2��t1����
CO2(g) + H2(g)���������ݼ��±�������t2��t1����
| ��Ӧʱ��/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | | | |
| t2 | | 0.20 | | |
 mol��L-1��min-1
mol��L-1��min-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ������п�ۺ�6mol��L-1�Ĺ������ᷴӦ���������м�����������������ʱ��һ���ܹ��ӿ췴Ӧ���ʣ��ֲ�Ӱ�����H2�������ǣ� ��
��ʯī ��CuO ��ͭ�� ������ ��Ũ���� ����ˮ����
| A���٢ۢ� | B���ڢܢ� | C���ڢݢ� | D���٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�ܱպ��������з������·�Ӧ��aX(g)+bY(g)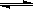 cZ(g) ��H��0����ƽ���������������ʱ������˵����ȷ����
cZ(g) ��H��0����ƽ���������������ʱ������˵����ȷ����
| A�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С, ƽ�ⳣ������ |
| B����ͨ��ϡ������ƽ�ⲻ�ƶ�����a+b=c |
| C���������������Ӧ���ʸı䣬��ƽ�ⲻ�ƶ� |
| D��������X������ƽ�������ƶ���X��ת�������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com