
如图是用于简单的有机化合物的制备、分离、提纯的常见简易装置.
请根据该装置回答下列问题:
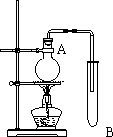
(1)若用正丙醇与乙酸反应制取乙酸正丙醇,则在烧瓶A中加入正丙醇与乙酸外,还应加入的试剂是________(填写名称).试管B中应加入________.试管B上方的导管除用于导气外,还兼有________的作用.
(2)若用该装置制备无水乙醇,则应在烧瓶A中加入无水乙酸钠和________.
(3)若用该装置制备溴乙烷,烧瓶A中加入NaBr晶体、乙醇和浓硫酸,试管B中加入少量水,则少量水起的作用是________.
(4)若用该装置分离乙酸和1-丙醇,则在烧瓶A中除加入1-丙醇与乙酸外,还应先加入适量的试剂是________,加热到一定温度,试管B中收集到的是________(填写化学式).冷却后再向烧瓶中加入试剂________,再加热到一定温度,试管B中收集到的是________(填写化学式).
科目:高中化学 来源: 题型:
 . 丁子香酚的一种同分异构体:
. 丁子香酚的一种同分异构体:




查看答案和解析>>
科目:高中化学 来源: 题型:



 )是一种重要的调味剂,它与F的关系是
)是一种重要的调味剂,它与F的关系是

 任意一种
任意一种 任意一种
任意一种查看答案和解析>>
科目:高中化学 来源: 题型:
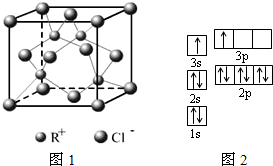 (1)下列是部分金属元素的电离能
(1)下列是部分金属元素的电离能| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源:江苏省无锡市2009届高三上学期模拟考试、化学 题型:022
甲醛亦称“蚁醛”.含甲醛37~40%、甲醇8%的水溶液俗称“福尔马林”.甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等.甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:室内甲醛含量不得超过0.08 mg·m-3.
(1)下列说法或做法不合理的是________.(填字母)
a.用甲醛溶液浸泡水产品以长时间保持水产品的“新鲜”
b.刚装修的新房入住前房间内保持一定温度并注意通风
c.对人体健康有危害的吊白块的合成反应NaHSO3+HCHO→NaO-CH2-SO3H的反应类型是加成反应
d.福尔马林可用于制作动物标本(或保存尸体)
(2)某研究性学习小组拟用甲醛法测定常见铵态氮肥的含氮量[资料:4NH4++6HCHO=(CH2)6N4H++3H++6H2O,所生成的H+和(CH2)6N4H+可用NaOH标准溶液滴定,采用酚酞作指示剂].用甲醛法测定含氮量,不适合的铵盐是____________.(填字母)
a.NH4HCO3
b.(NH4)2SO4
c.NH4Cl
(3)甲醇脱氢是制甲醛最简单的工业方法:
反应Ⅰ:CH3OH(g)→HCHO(g)+H2(g);ΔH1=92.09 kJ·mol-1,其平衡常数K1=3.92×10-11
甲醇氧化是制甲醛的另一种工业方法,即甲醇蒸气和一定量的空气通过Ag催化剂层,甲醇即被氧化得到甲醛:
反应Ⅱ:CH3OH(g)+![]() O2(g)→HCHO(g)+H2O(g);ΔH2=-149.73 kJ·mol-1,其平衡常数K2=4.35×1029
O2(g)→HCHO(g)+H2O(g);ΔH2=-149.73 kJ·mol-1,其平衡常数K2=4.35×1029
(上述数据均为298.15 K下测定.)
①绿色化学提倡化工生产应提高原子利用率.原子利用率表示目标产物的质量与生成物总质量之比.反应________(填“Ⅰ”或“Ⅱ”)制甲醛原子利用率更高.从反应的焓变和平衡常数K值看,反应________(填“Ⅰ”或“Ⅱ”)制甲醛更加有利.
②反应Ⅱ自发进行的条件是________.
a.高温
b.低温
c.任何条件都自发
③如图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化.图中曲线(1)表示的是反应_______(填“Ⅰ”或“Ⅱ”).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com