
2010年诺贝尔化学奖化学授予理查德·赫克等三位科学家,以表彰他们在“钯催化交叉偶联”方面的研究。下面关于催化剂的说法正确的是( )
A.催化剂只改变反应的正反应速率
B.催化剂通过升高反应的活化能来加快反应速率
C.催化剂能够改变反应的反应热
D.催化剂不能改变反应物的转化率
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
A.将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同
B.盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快
C.将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快
D.升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第四章 电化学基础练习卷(解析版) 题型:选择题
如下图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )
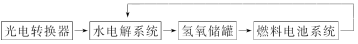
向日面时 背日面时
A.该能量转化系统工作时,需不断补充H2O
B.该转化系统的能量本质上来源于太阳能
C.水电解系统中的阴极反应:O2+2H2O+4e-=4OH-
D.燃料电池放电时的负极反应:H2-2e-=2H+
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷(解析版) 题型:选择题
设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
下列有关叙述正确的是( )
A.b<0
B.在973 K下增大压强,K2增大
C.a>b
D.在常温下反应①一定能自发进行
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH>0 ΔS>0
B.凡是放热反应都是自发的,凡是吸热反应都是非自发的
C.常温下,2H2O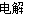 2H2↑+O2↑,即常温下水的分解反应是自发反应
2H2↑+O2↑,即常温下水的分解反应是自发反应
D.对于反应H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第三章 水溶液中的离子平衡练习卷(解析版) 题型:实验题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 (保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是: 。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将 (填“增大”“减小”或“不变”)。
实验三:探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:
。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第三章 水溶液中的离子平衡练习卷(解析版) 题型:选择题
在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀。最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
| AgCl | AgI | Ag2S |
Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第一章 化学反应与能量练习卷(解析版) 题型:选择题
一些烷烃的燃烧热如下表:
化合物 | 燃烧热/kJ/mol | 化合物 | 燃烧热/kJ/mol |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
下列表达正确的是( )
A.正戊烷的燃烧热大于3531.3 kJ/mol
B.稳定性:正丁烷<异丁烷
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)ΔH=-1560.8 kJ/mol
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
查看答案和解析>>
科目:高中化学 来源:2014年甘肃省第二学期第二学段段中考试化学(理科)试卷(解析版) 题型:填空题
某有机物的结构简式为: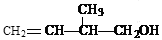
(1)该有机物中所含官能团的名称是_______________________________________;
(2)该有机物发生加聚反应后,所得产物的结构简式为_______________________;
(3)写出该有机物发生催化氧化的化学方程式(注明反应条件)_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com