
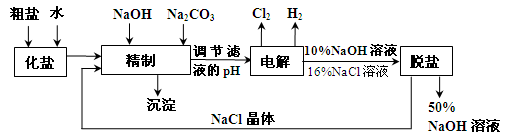
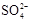 ,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。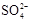 (已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。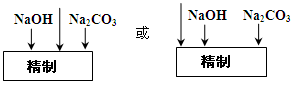
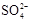 促使BaCO3(s)
促使BaCO3(s) Ba2+(aq)+
Ba2+(aq)+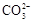 (aq)
(aq)

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:问答题
 CO2(g)+H2(g)
CO2(g)+H2(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫铁矿煅烧前将要矿粒粉碎,因为大块的硫铁矿不能燃烧 |
| B.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应 |
| C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率 |
| D.SO3用质量分数为98%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
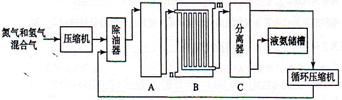
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
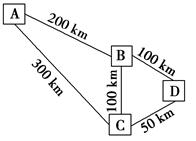
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH<0,下列说法正确的是( )。
2NH3(g) ΔH<0,下列说法正确的是( )。| A.达到平衡时反应物和生成物浓度一定相等 |
| B.达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时大 |
| C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应的方向移动 |
| D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
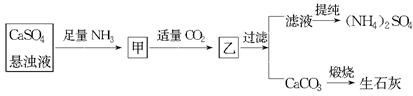
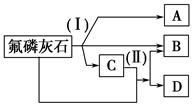
| A.直接蒸干滤液得到纯净的(NH4)2SO4 |
| B.生成1 mol(NH4)2SO4至少消耗2 mol NH3 |
| C.CO2可被循环使用 |
| D.往甲中通入CO2有利于(NH4)2SO4生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
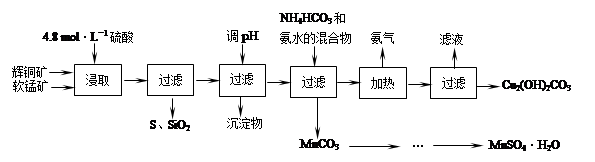
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在一支试管中分别加入2~3ml水和几滴植物油,振荡,得到的是悬浊液 |
| B.用小木棍蘸少量浓硫酸在白纸上写字,一会儿白纸变黑,小木棍也变黑了 |
| C.在一支试管中加入几小段镁条,再加入5ml盐酸,观察到镁条表面有气泡,用手触摸试管外壁,感觉不到温度的变化 |
| D.向一个收集满二氧化碳气体的质地较软的塑料瓶中加入约三分之一体积水,立即旋紧瓶盖,振荡,塑料瓶没有明显变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com