
(18分)(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于分解反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于化合反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.(NH4)2SO3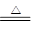 2NH3↑+H2O+SO2↑
2NH3↑+H2O+SO2↑
B.2CO+O2 2CO2 C.2C+SiO2
2CO2 C.2C+SiO2 Si+2CO↑
Si+2CO↑
D.NH4NO3 N2O+ 2H2O
N2O+ 2H2O
E.CaCO3 + CO2+ H2O=Ca(HCO3)2
F.MnO2 + 4HCl(浓) 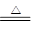 MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(2)根据反应Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②被还原的硝酸与未被还原的硝酸的物质的量比是________。
③用单线桥表示此反应转移的电子数目及方向。
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
(18分)(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于分解反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于化合反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.(NH4)2SO32NH3↑+H2O+SO2↑
B.2CO+O22CO2 C.2C+SiO2
Si+2CO↑
D.NH4NO3N2O+ 2H2O
E.CaCO3+ CO2+ H2O=Ca(HCO3)2
F.MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
(2)根据反应Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②被还原的硝酸与未被还原的硝酸的物质的量比是________。
③用单线桥表示此反应转移的电子数目及方向。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年重庆市重庆一中高一上学期期中考试化学试卷 题型:填空题
(18分)(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于分解反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于化合反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.(NH4)2SO3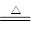 2NH 2NH 3↑+H2O+SO2↑ 3↑+H2O+SO2↑ |
B.2CO+O2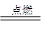 2CO2 2CO2 |
C.2C+SiO2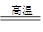 Si+2CO↑ Si+2CO↑ |
D.NH4NO3 N2O+ 2H2O N2O+ 2H2O |
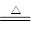 MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省昆明市官渡区二中高二9月月考化学试卷(带解析) 题型:实验题
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据: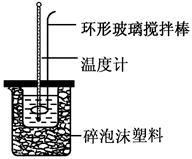
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川成都外国语学校高三10月月考化学卷 题型:实验题
Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度 ②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)NaOH溶液稍过量的原因 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 。
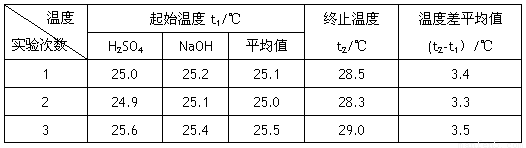
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,请根据实验数据求出中和热为 写出该反应的热化学方程式_________
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是
Ⅱ.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL
试填空:
(1)正确操作步骤的顺序是 (用字母表示)。
(2)观察滴定管液面的高度时应注意
(3)E步骤的操作中锥形瓶下垫一张白纸的作用是 。
(4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低”或“无影响”),原因是
(5)该烧碱样品纯度的计算式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com