
【题目】下列叙述正确的是( )
A. SO2能使品红溶液褪色,是因为SO2具有氧化性将品红氧化
B. 9g 重水(D2O)中含有5mol质子
C. 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D. 同位素的物理性质和化学性质完全相同
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】某反应2NH3![]() N2+3H2在三种不同条件下进行,N2、H2的起始浓度均为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2+3H2在三种不同条件下进行,N2、H2的起始浓度均为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
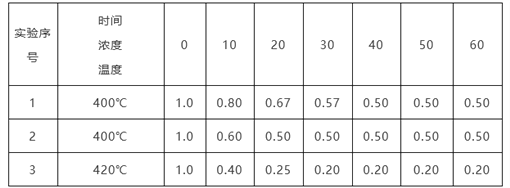
根据上述数据,回答下列问题:
(1)在实验1、2中,有一个实验使用了催化剂,它是______(填字母)。
A.实验1 B.实验2
(2)在实验3中,平衡时NH3的转化率为__________________。
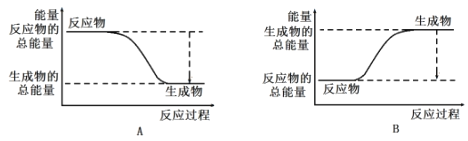
(3)工业合成氨的反应如下:N2+3H2![]() 2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中的能量变化为_______kJ。下图能正确表示该反应中能量变化的是______(填字母)。
2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中的能量变化为_______kJ。下图能正确表示该反应中能量变化的是______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中氯化钠是由![]() 与
与![]() 和
和![]() 所构成的。已知氯元素的相对原子质量是35.5,则11.7g氯化钠中,含
所构成的。已知氯元素的相对原子质量是35.5,则11.7g氯化钠中,含![]() 的质量为( )
的质量为( )
A. 1.75g B. 1.85g C. 5.25g D. 5.55g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Cu﹣Zn原电池的装置示意图,下列叙述正确的是( ) 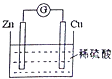
A.Zn片是正极
B.电池工作时,H+在铜片上得电子
C.电池工作时,电能转变为化学能,且锌片逐渐被消耗
D.电池工作时,电子从锌片通过硫酸溶液流向铜片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E和F表示含有10个电子的微粒,请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是______;(填离子符号)
(2)D是由两种元素组成的分子,其水溶液呈碱性,D的结构式是_______________;
(3)向含B微粒溶液中加入含F微粒溶液,先出现白色沉淀,继续加入含F微粒溶液沉淀溶解,写出该过程的离子方程式__________________________________
(4)向含E微粒溶液中加入含F微粒溶液,并加热生成 C和D,写出该离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
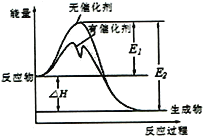
A. 该反应的逆反应为放热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能大于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-2akJ·mol-1
2SO3(g) ΔH =-2akJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com