分析:根据①可知,A、B溶液中水的电离程度比纯水大,说明存在水解的离子,故A、B中含有的离子:一个含有NH4+、另一个含有CO32-,
根据②可知,B溶液和C溶液混合时只产生刺激性气味的气体,则该气体为NH3,为NH4+与OH-反应,故B、C中含有的离子:一个含有NH4+、另一个含有OH-.A、C溶液的pH均大于7,故C一定含有OH-,B含NH4+;C溶液和D溶液混合时只产生白色沉淀,只能为Ba2+与CO32-、SO42-,由于每种物质只含一种阴离子且互不重复,故C含有Ba2+,故C为Ba(OH)2,则D为Na2SO4、B为NH4Cl,故A含有CO32-,A溶液的pH均大于7,故Na2CO3或(NH4)2CO3,据此分析.
解答:解:根据①可知,A、B溶液中水的电离程度比纯水大,说明存在水解的离子,故A、B中含有的离子:一个含有NH4+、另一个含有CO32-,
根据②可知,B溶液和C溶液混合时只产生刺激性气味的气体,则该气体为NH3,为NH4+与OH-反应,故B、C中含有的离子:一个含有NH4+、另一个含有OH-.A、C溶液的pH均大于7,故C一定含有OH-,B含NH4+;C溶液和D溶液混合时只产生白色沉淀,只能为Ba2+与CO32-、SO42-,由于每种物质只含一种阴离子且互不重复,故C含有Ba2+,故C为Ba(OH)2,则D为Na2SO4、B为NH4Cl,故A含有CO32-,A溶液的pH均大于7,故Na2CO3或(NH4)2CO3,
A.由上述分析可知,B为NH4Cl,故A正确;
B.等体积、等物质的量浓度的B溶液和C溶液混合,钡离子、氯离子不发生反应,故所得溶液中c(Cl-)=c(Ba2+),故B错误;
C.若A为Na2CO3,溶液中氢氧根由水提供,水提供的氢离子,部分以氢离子形式存在、部分转化为碳酸氢根、碳酸分子,由水提供的氢氧根、氢离子相等可知,c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C正确;
D.所得混合液的pH=7,则V[Ba(OH)2]×0.15 mol?L-1×2=V(盐酸)×0.2 mol?L-1,故V[Ba(OH)2]:V(盐酸)=2:3,故D正确;
故选B.
点评:本题考查离子及无机物推断,涉及离子反应、盐类水解、pH值有关计算等,题目难度中等,推断物质是解题的关键,没有信息中学一般不考虑弱酸弱碱盐的酸碱性判断.



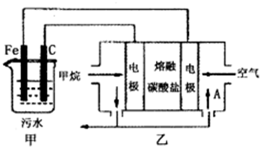 (2013?金华模拟)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
(2013?金华模拟)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )