
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件) 。
(2)实验室中还可以采用如图1装置(略去了夹持装置)和药品快速制备氨气:

①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是 (填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O 
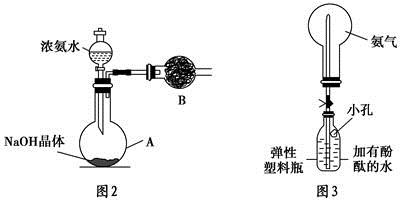
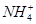 +OH-,NaOH晶体使该可逆反应的平衡向左移动
+OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气 个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图2,装置B中盛装的干燥剂是 。
②该同学利用图3装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法: 。
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O (2)①c ②3
2NH3↑+CaCl2+2H2O (2)①c ②3
(3)①碱石灰 ②用一手指肚堵住塑料瓶上的小孔,然后轻轻挤压塑料瓶,将少量水挤入烧瓶,手指肚离开小孔
【解析】(2)第二种制备氨气的方法中利用了一水合氨的分解反应,与铵盐、熟石灰的反应原理不同;若10 mL 34%的0.89 g·mL-1的浓氨水中的NH3·H2O全部分解,生成的NH3的物质的量为10 mL×34%×0.89 g·mol-1÷35 g·mol-1=0.086 5 mol,标准状况下的体积为0.086 5 mol×22.4 L·mol-1=1.937 6 L,用体积为0.5 L的烧瓶收集时,因为最后一瓶收集不满,故最多只能收集满3个烧瓶。(3)干燥管中只能盛装固体干燥剂,但氨气不能用无水氯化钙干燥。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学物质的分离和提纯(解析版) 题型:实验题
菠菜营养丰富,长期以来民间流传着“菠菜不能与豆腐同食”的说法。某学校化学兴趣小组的同学拟通过实验探究:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4·2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体。
他们设计的实验步骤如下:
1.将菠菜在少量开水中煮沸2~3 min,冷却后滤去菠菜,得滤液(含有少量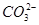 杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
2.用草酸晶体(H2C2O4·2H2O)做以下实验:
请回答以下问题:
(1)步骤1中加入CH3COOH溶液的作用: 。
(2)A处应选择 (填“Ⅰ”或“Ⅱ”),在做实验之前,应先 。
(3)实验2过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中草酸晶体(H2C2O4·2H2O)发生反应的化学方程式: ,装置B的作用是 。
(4)为使实验结论更加严密和安全,在以上所连接的装置C、D间还需依次添加装有 、 、 (液体试剂)的洗气瓶,此外指出上述装置中的不足之处还有 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学水的电离与溶液酸碱性(解析版) 题型:选择题
如图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是

A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氮气、氧化物及硝酸(解析版) 题型:实验题
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发现的有关问题。
Ⅰ.探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的浓硫酸、稀硫酸、浓硝酸、稀硝酸,实验结果记录如下表:
| 酸 | 实验结果 |
a | 浓硫酸 | 加热后发生反应,产生无色刺激性气体 |
b | 稀硫酸 | 加热也不发生反应 |
c | 浓硝酸 | 不加热即发生反应,产生红棕色气体 |
d | 稀硝酸 | 微热发生反应,产生无色气体 |
①由上表中实验结果,四种酸的氧化性由强到弱的顺序是 。
②由上表可知,铜与稀硫酸在加热条件下不反应,但若同时通入O2,铜片能逐渐溶解,溶液变为蓝色。写出该反应的化学方程式: 。
(2)先将铜与浓硫酸反应产生的气体X持续通入如图所示装置中,一段时间后再将铜与浓硝酸产生的气体Y也持续通入该装置中,则整个过程中可观察到的现象包括 (填字母)。

A.通入X气体后产生白色沉淀
B.通入X气体后溶液无明显现象
C.通入Y气体后产生沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是 (填字母)。
A.硝酸的酸性比硫酸强
B.H2SO3的酸性比盐酸强
C.HNO3能氧化H2SO3(或SO2)
D.BaSO4既不溶于水也不溶于HNO3溶液
Ⅱ.如图是某同学探究铜与稀硝酸反应的还原产物的实验装置图,请回答下列问题:
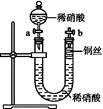
(1)写出铜与稀硝酸反应的离子方程式: 。
(2)已知装置气密性良好,请简述利用该装置证明铜与稀硝酸反应生成的气体产物是NO的操作过程: 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氮气、氧化物及硝酸(解析版) 题型:选择题
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
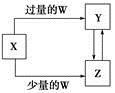
选项 | W | X |
A | 盐酸 | Na2CO3溶液 |
B | 稀HNO3 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | O2 | Na |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原规律(解析版) 题型:选择题
已知氧化性:Cl2>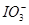 >Fe3+>I2,以下实验的结论或实验的预测合理的是
>Fe3+>I2,以下实验的结论或实验的预测合理的是
A.往溶液中加入过量的氯水再加淀粉,振荡不出现蓝色,说明没有I-
B.向FeCl2溶液中滴加碘水,所得溶液中加入KSCN溶液将呈红色
C.向淀粉碘化钾试纸上滴白醋和加碘盐的溶液,试纸变蓝,说明加碘盐中有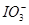
D.往FeI2溶液中滴加少量氯水,溶液变成棕黄色,说明有Fe3+生成
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原反应方程式的配平及相关计算(解析版) 题型:填空题
已知:氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①向其中加入适量的NaBiO3,溶液变为紫红色。②继续滴加适量H2O2,紫红色褪去,并有气泡产生。③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式: 。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是 。
(4)若实验②放出了336 mL气体(标准状况),则反应①被氧化的Mn(NO3)2为 mol。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学有机推断(解析版) 题型:填空题
莫沙朵林是一种镇痛药,它的合成路线如下:

(1)B中手性碳原子数为 ;化合物D中含氧官能团的名称为 。
(2)C与新制氢氧化铜反应的化学方程式为 。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
①核磁共振氢谱有4个峰;
②能发生银镜反应和水解反应;
③能与FeCl3溶液发生显色反应。
(4)已知E+X F为加成反应,化合物X的结构简式为 。
F为加成反应,化合物X的结构简式为 。
(5)已知: 化合物
化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com