



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年山东省淄博市高三3月模拟考试理综化学试卷(解析版) 题型:填空题
硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。
(1)某研究小组设计SnSO4制备路线如下:

已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
①SnCl2酸溶后加入Sn粉的作用是??????????????????????? 。
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有????????????? ;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为???????????????? 。
③步骤Ⅴ涉及到的操作有:a.过滤? b.洗涤? c.蒸发浓缩? d.冷却结晶? e.低温干燥,则其正确的操作顺序为??????????????????????? 。
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。
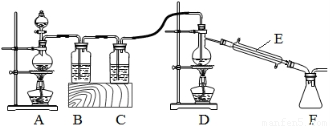
①装置C中应加入试剂为___________;仪器E的名称为____________________。
②反应开始生成SnCl4时,可以先熄灭___(填字母序号)处的酒精灯,理由是________。
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等)______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省“江南十校”高三3月联考理综化学试卷(解析版) 题型:填空题
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组
设计SnSO4制备路线如下:
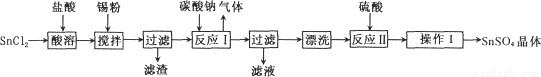
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]
回答下列问题:
(1)操作l的步骤为 ____、____、过滤、洗涤、干燥。对沉淀进行洗涤的方法是_____________。
(2) SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:________。
(3)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是:________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnC12中加入过量的FeC13溶液,用b mol/LK2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液m ml。则锡粉中锡的质量分数是________。(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com