
今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为 ▲ 堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg ▲ Al | O ▲ S | MgO ▲ MgS | H2O ▲ H2S |
(3)基态铬原子外围电子轨道表示式为 ▲ 。
科目:高中化学 来源: 题型:
为提纯下列物质(括号内为少量杂质),所选除杂试剂与主要分离方法都正确的是
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为
A.C2H6(g) +  O2(g)=2CO2(g) +3H2O(l) △H =-1560kJ·mol-1
O2(g)=2CO2(g) +3H2O(l) △H =-1560kJ·mol-1
B.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(g) △H =-1560kJ·mol-1
C.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(l) △H =+3120 kJ·mol-1
D.C2H6(g) + O2(g)=2CO2(g) +3H2O(l) △H =-52.0kJ·mol-1
O2(g)=2CO2(g) +3H2O(l) △H =-52.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.010mol·L-1NaI溶液与Pd(NO3)2溶液等体积混合,若有PdI2沉淀生成[已知:Ksp(PdI2)=7.0×10-9],则原Pd(NO3)2溶液最低浓度为
A.7.0×10-7 mol·L-1 B.2.8×10-4 mol·L-1
C.5.6×10-4 mol·L-1 D.7.0×10-5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【选做题】本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。
若多做,则按A小题评分。
A.[物质结构与性质]
利用反应:Cu2Cl2 +C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔。
(1)基态时亚铜离子核外电子排布式为 ▲ 。
(2)NH3中氮原子的杂化方式为 ▲ ;NH4+空间构型为 ▲ (用文字描述)。
(3)乙炔分子中σ键与π键数目之比为 ▲ ,与C22-互为等电子体的分子有 ▲ (写化学式,举一例)。
(4)氯化亚铜晶胞结构如下图,晶胞中含Cu+数目为 ▲ 。
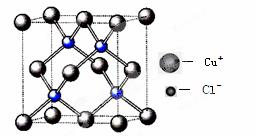
(5)合成氨工业常用铜(I)氨溶液吸收CO生成[Cu(NH3)3(CO)]+,该配离子中配体有 ▲ (写化学式)。
B.[实验化学]
已二酸是一种重要的化工中间体,可通过氧化环已醇得到。
反应原理为:
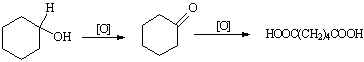
实验步骤:
步骤1.在图①所示装置的三颈瓶中加入6gKMnO4和50mL0.3mol/LNaOH溶 液,搅拌加热使之溶解。
液,搅拌加热使之溶解。
步骤2.在继续搅拌下用滴管滴加21mL环已醇,控制滴加速度,维持反应温度43~47℃。滴加完毕后, 在沸水浴中将混合物加热几分钟。
在沸水浴中将混合物加热几分钟。
步骤3.用图②所示装置趁热抽滤,二氧化锰滤渣用水洗2~3次
步骤4.滤液用小火加热蒸发浓缩至原来体积的一半,冷却后再用浓盐酸酸化至pH为2~4,冷却析出粗产品
步骤5.将粗产品用水进行重结晶提纯,然后在烘箱中烘干。
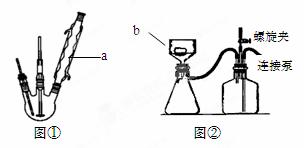
(1)写出实验仪器名称:a ▲ ; b ▲ 。
(2)步骤2在沸水浴中将混合物加热几分钟的目的是: ▲ 。
(3)步骤3趁热抽滤的目的是: ▲ ;如 何证明步骤3滤渣已洗涤干净: ▲ 。
何证明步骤3滤渣已洗涤干净: ▲ 。
(4)步骤4用盐酸酸化的目的是: ▲ 。
(5)确定最后产品成分为已二酸,还需做的实验或仪器分析有 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下, 恒容密闭容器中, 充入一定量的NO和O2, 发生反应O2(g)+2NO(g)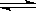 2 NO2(g) , 反应已达到平衡的标志是
2 NO2(g) , 反应已达到平衡的标志是
A.混合气体的颜色不再变化 B.O2 、NO、NO2三种物质的反应速率之比为1∶2 ∶2
C.反应混合物中各组分物质的浓度相等 D.混合气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,0.1mol·L-1的某一元碱MOH溶液pH = 13,将它和某一元酸HA的溶液等体积混合,混合后的溶液恰好为中性。下列判断正确的是( )
A.HA溶液的pH一定为1 B.盐MA可能水解
C.HA物质的量浓度一定为0.1mol·L-1 D.混合后溶液中,c(M+)一定等于c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 5 。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4(l) ΔH1=-195kJ·mol-1
②N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH2=-534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com