
| A. | ①③④ | B. | ③④⑥ | C. | ①②④ | D. | ①③④⑤ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
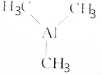 )可用于金属有机化合物气相沉积,下列有关说法正确的是( )
)可用于金属有机化合物气相沉积,下列有关说法正确的是( )| A. | 三甲基铝的摩尔质量是72 | |
| B. | 14.4g三甲基铝中碳原子数为0.6NA | |
| C. | 0.5mol三甲基铝的质量为36g•mol-1 | |
| D. | 1mol三甲基铝在标准状况下的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下$\frac{c({H}^{+})}{c({OH}^{-})}$=1012的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 含有大量Al3+的溶液中:Na+、NH4+、Cl-、HCO3- | |
| C. | 能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br- | |
| D. | 常温下,由水电离出的c(H+)=1×10-13 mol•L-1的溶液中:K+、Fe3+、CH3COO-、SO42-电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com