
| A. | 将少量Na2O2粉末加入到H218O水中:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| B. | 向AlC13溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 氯化亚铁溶液中通入足量C12:Fe2++C12═Fe3++2C1- | |
| D. | 往NH4HSO4溶液中加入足量NaOH溶液:NH4++H++2OH-═NH3•H2O+H2O |
分析 A.氧气中氧元素来自过氧化钠,18O原子反应后进入氢氧根离子;
B.氨水为弱碱,二者反应生成氢氧化铝沉淀;
C.离子方程式两边正电荷不相等,不满足电荷守恒;
D.强氧化钠足量,反应生成硫酸钠、一水合氨和水.
解答 解:A.过氧化钠与H218O,氧气中氧元素来自过氧化钠,18O原子反应后进入氢氧根离子,正确的离子方程式为:2H218O+2Na2O2=4Na++2OH-+218OH-+O2↑,故A错误;
B.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.氯化亚铁溶液中通入足量C12,正确的离子方程式为:2Fe2++C12═2Fe3++2C1-,故C错误;
D.NH4HSO4溶液中加入足量NaOH溶液,反应的离子方程式为:NH4++H++2OH-═NH3•H2O+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
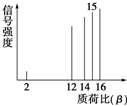 质谱法能够对有机分子进行结构分析.其方法是让极少量的(10-9 g)化合物通过质谱仪的离子化室,样品分子大量离子化,少量分子碎裂成更小的离子,然后测定其质荷比.其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),该有机物可能是( )
质谱法能够对有机分子进行结构分析.其方法是让极少量的(10-9 g)化合物通过质谱仪的离子化室,样品分子大量离子化,少量分子碎裂成更小的离子,然后测定其质荷比.其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),该有机物可能是( )| A. | 甲醇(CH3OH) | B. | 甲烷 | C. | 丙烷 | D. | 乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 迄今人类发现的元素中,金属元素和非金属元素种数相近 | |
| B. | 元素周期表有18个纵行16个族,分为主族、副族、第Ⅷ族和零族 | |
| C. | 元素周期表有七个周期,分为短周期和长周期和不完全周期 | |
| D. | 人们在周期表中金属与非金属的分界处可以找到半导体材料,如硅、锗等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com