
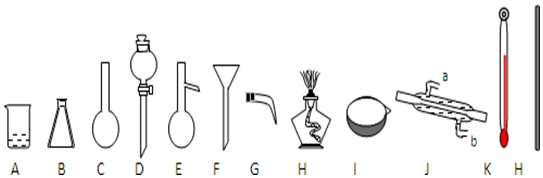
分析 ①由图可知仪器的名称;
②酒精与水互溶,不能作萃取剂;
③蒸馏装置中,在E中加入沸石防止液体剧烈沸腾,冷凝管中冷水下进上出,冷却效果好.
解答 解:①由图可知仪器D、J的名称分别为分液漏斗、冷凝管,故答案为:分液漏斗;冷凝管;
②萃取不能否用酒精代替四氯化碳进行实验,因酒精与水互溶,不能作萃取剂,故答案为:否;酒精与水互溶;
③蒸馏装置中,在E中加入沸石的目的是防止暴沸,冷凝管中冷水下进上出,冷却效果好,则仪器J的冷凝水应该b进a出,故答案为:防止暴沸;b; a.
点评 本题考查混合物分离提纯,为高频考点,把握仪器的使用、混合物分离提纯实验为解答的关键,侧重分析与实验能力的考查,注意萃取、蒸馏的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
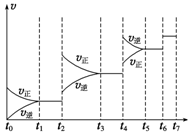 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、Na+、K+ | B. | SO42-、Cl-、K+ | C. | Cl-、NO3-、K+ | D. | HCO3-、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质燃烧都是吸热反应 | B. | 化学反应总是伴随着能量的变化 | ||
| C. | 需要加热的反应一定是吸热反应 | D. | 化学反应中放出的热量就是反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠与盐酸反应:CO3-+2H+═H2O+CO2↑ | |
| C. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④① | B. | ④①②③ | C. | ①④②③ | D. | ③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
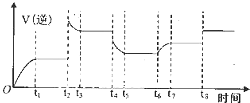 合成氨工业上常用下列方法制备H2:
合成氨工业上常用下列方法制备H2:| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com