
【题目】已知[Co(NH3)6]3+呈正八面体结构:各NH3分子间距相等,Co3+位于正八面的中心。若其中二个NH3分子被Cl-取代,所形成的[Co(NH3)4Cl2]+的同分异构体的种数有( )
A. 2种 B. 3种 C. 4种 D. 5种
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( )

A. 铜电极上发生还原反应
B. 电池工作一段时间后,c(SO42-)向锌电极移动,甲池的c(SO42-)增大
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 电流的方向:由铜电极经过导线流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别进行下列操作,由现象得出的结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加Ba(NO3)2和HNO3混合溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 将乙烯通入溴水中 | 溴水褪色 | 乙烯与溴水发生氧化反应 |
C | 分别将少量钠投入到盛有水和乙醇的烧杯中 | 盛水烧杯中反应剧烈 | 水中的氢比乙醇中的氢活泼性强 |
D | 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铁和铜的混合物中,加入一定量的稀硝酸,使之充分反应,剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2关系是( )
A.m1一定大于m2
B.m1可能小于m2
C.m1可能等于m2
D.m1一定等于m2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
① Q为元素周期表中原子半径最小的元素;
② R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③ Y的基态原子的核外成对电子数是未成对电子数的3倍;
④ Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示):
(1)Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,化合物M的空间构型为____________,其中心原子采取_______杂化;Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,化合物N在固态时的晶体类型为____。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为________________。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为_____(写分子式)。
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质,该反应的离子方程式为_________________________。
(5)某含Z配合物,化学式为[ZCl(H2O)5]Cl2, 配位数为____,1 mol该配合物中![]() 键的数目为___。
键的数目为___。
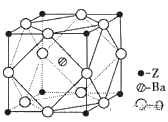
(6)Z原子基态时的价电子排布式为__________;已知Z的一种含氧酸钡盐的密度为ρ g.cm-3,其晶胞的结构如图所示,则晶体中氧原子与钡原子的最近距离为_______cm。(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Cl-、CO32-、SO42-三种阴离子,如果只取一次溶液,分别将三种离子检验出来,下列加入试剂及其顺序(从左至右)正确的是( )
A.氯化钡溶液、硝酸、硝酸银溶液B.硝酸、硝酸银溶液、氯化钡溶液
C.硝酸、硝酸钡溶液、硝酸银溶液D.稀硫酸、硝酸钡溶液、硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液,下列说法中正确

A. 放电时K+移向负极
B. 放电时电池负极的电极反应为H2-2e-===2H+
C. 放电时电池正极的电极反应为NiO(OH)+H2O+e-===Ni(OH)2+OH-
D. 该电池充电时将碳电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用铁粉制备摩尔盐的操作流程如下:
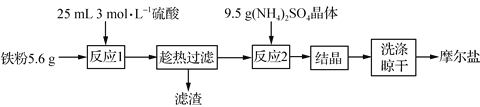
(1)流程中“趁热”过滤的原因是__________。
(2) 反应1制得硫酸亚铁的物质的量理论上应小于__________mol。
(3)为确定摩尔盐的化学式,进行如下实验:现称取4.704 g新制摩尔盐,溶于水配制成100.0 mL溶液,再将该溶液分成两等份。
向其中一份溶液中加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸
变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体2.796 g。
另一份溶液用0.050 0 mol·L-1 K2Cr2O7酸性溶液滴定,当Cr2O![]() 恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00 mL。
恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00 mL。
①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO![]() 离子沉淀完全(即该离子浓度须小于1×10-5 mol·L-1),则此时c[(Ba(OH)2]≥__________mol·L-1。
离子沉淀完全(即该离子浓度须小于1×10-5 mol·L-1),则此时c[(Ba(OH)2]≥__________mol·L-1。
②确定该摩尔盐的化学式(写出计算过程)。___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com