
| A. | 通入氢气的一极为电池的正极 | |
| B. | 当电池中生成1 mol水时,转移4 mol电子 | |
| C. | 正极反应为4OH--4e-=2H2O+O2↑ | |
| D. | 放电时CO32-向负极移动 |
分析 A、通入氢气失电子,为电池的负极;
B、生成1mol水转移2mol电子;
C、生成1mol水转移2mol电子;
D、电池放电时,阴离子向负极移动.
解答 解:A、通入氢气失电子,为电池的负极,故A错误;
B、已知该电池的总反应为2H2+O2═2H2O,则生成1mol水转移2mol电子,故B错误;
C、燃料电池中,正极发生的是氧气得电子的反应过程,电极反应为:O2+2CO2+4e-→2CO32-,故C错误;
D、电池放电时,阴离子向负极移动,则CO32- 向负极移动,故D正确;
故选D.
点评 本题是一道有关燃料电池的工作原理的综合题目,要求学生熟悉原电池原理,把握正负极的判断方法和电极方程式的书写方法,具备分析和解决问题的能力,题目难度中等.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 醋酸钠溶液 | 醋酸溶液 | 盐酸 |
| A. | ①、②两溶液相比,后者对水的电离的抑制程度大于前者 | |
| B. | ③、④两种溶液中分别加水稀释100倍,pH变化较大的是③ | |
| C. | 等体积的③、④溶液中分别加入过量锌粒,产生的氢气前者大于后者 | |
| D. | ①、④两溶液等体积混合后,溶液中微粒浓度满足c(NH4+)+c(NH3•H2O)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; (R1、R2代表烃基或氩原子)
(R1、R2代表烃基或氩原子)
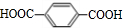 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;反应⑦的化学方程式为
+2H2O;反应⑦的化学方程式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2吸收溴单质时发生反应的化学方程式为:2H2O+SO2+Br2═H2SO3+2HBr | |
| B. | 海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2═Br2+2Cl- | |
| C. | Cl-的结构示意图为: | |
| D. | 海水中Br-的电子式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | 氧化铝 | C. | 氢氧化钠 | D. | 氢氧化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是能起银镜反应的物质一定是醛 | |
| B. | 乙烯和甲苯都能使酸性高锰酸钾溶液褪色 | |
| C. | 苯酚有弱酸性,俗称石炭酸,因此它是一种羧酸 | |
| D. | 在酯化反应中,羧酸脱去羧基中的氢原子,醇脱去羟基生成水和酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com