
 2010上海世博上,零排放、太阳能、绿色光源等成为高科技亮点.
2010上海世博上,零排放、太阳能、绿色光源等成为高科技亮点.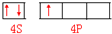 ;
; ;4;
;4;

 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 实验方案或操作 |
| A | 证明某溶液中含有SO42- | 向溶液中滴加酸化的Ba(NO3)2 溶液出现白色沉淀 |
| B | 证明某固体是NH4Cl | 取固体溶于水,加入硝酸酸化后加入硝酸银溶液,若有白色沉淀,证明固体是NH4Cl |
| C | 证明Al2O3的熔点比Al高 | 把砂纸打磨过的铝箔在酒精灯上加热到熔化 |
| D | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4 溶液中,紫色褪去 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
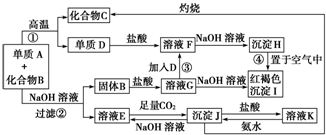
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
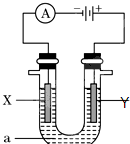 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com