
下列各组顺序的排列不正确的是( )
| A.原子半径:Na>Mg>Al>H | B.热稳定性: HC l<H2S<PH3 |
| C.酸性强弱:H2SiO3<H2CO3<H3PO4 | D.氧化性:K+<Na+<Mg2+<Al3+ |
B
解析试题分析:A.Na、Mg、Al是第三周期的元素,元素的原子序数越大,原子半径就越小。而H是第一周期的元素。元素的原子核外电子层数越多,原子半径就越大。所以原子半径:Na>Mg>Al>H。正确。B.元素的非金属性:Cl>S>P.亅的非金属性越强,其氢化物的稳定性就越强。因此热稳定性: HC l>H2S>PH3。错误。C.元素的非金属性:P>C>Si,元素的非金属性越强,其最高价的含氧酸的酸性就越强。所以酸性强弱:H2SiO3<H2CO3<H3PO4。正确。D.元素的金属性:K>Na>Mg>Al.元素的金属性越强,其离子与电子的结合力就越弱。即氧化性越弱。因此氧化性:K+<Na+<Mg2+<Al3+。正确。
考点:考查原子半径、离子的氧化性、元素的氢化物及最高价含氧酸的酸性强弱的比较的知识。


科目:高中化学 来源: 题型:单选题
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是
| A.W、M的某种单质可作为水处理中的消毒剂 |
| B.电解YW2的熔融物可制得Y和W的单质 |
| C.相同条件下,W的氢化物水溶液酸性比Z弱 |
| D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.微粒X2-与Y2+核外电子排布相同,离子半径:X2-> Y2+ |
| B.人们可在周期表的过渡元素中寻找催化剂、耐腐蚀和耐高温的合金材料 |
| C.由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>F |
| D.Be元素与Al元素同处在周期表的金属与非金属的交界处,可推出: |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素周期表和元素周期律对与化学相关的科学技术具有指导作用,人们常在元素周期表中一定的区域内寻找特殊物质,其中寻找催化剂的区域为( )
| A.金属与非金属的分界线附近区域 | B.过渡元素区域 |
| C.氟、氯、硫、磷等元素附近区域 | D.元素周期表左下部分主族元素区域 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X 、Y、 Z、 W是原子序数依次增大的四种短周期元素,A、B、C、D、F有其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol·L-1D溶液的pH为13(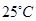 )。它们满足如图转化关系,则下列说法正确的是( )
)。它们满足如图转化关系,则下列说法正确的是( )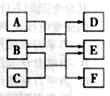
A.原子半径W>Z>Y>X
B.化合物F中含有共价键和离子键
C.在B和C的反应中,氧化剂是B,还原剂是C
D.Z元素的最高正价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )
| A.元素非金属性由弱到强的顺序为Z<Y<X |
| B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C.3种元素的气态氢化物中Z的气态氢化物最稳定 |
| D.原子半径由大到小的顺序为Z<Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述中正确的是( )
| A.离子半径:C>D>B>A | B.原子序数:d>c>b>a |
| C.原子半径:A>B>C>D | D.单质的还原性:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列结论不正确的是
A粒子半径:S>S2->Cl-
B氢化物沸点:H2O>HF>HCl
C结合质子能力:OH->SiO>CO
D离子还原性:S2->I->Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com