
| A. | K+、Ba2+、NO3-、Cl- | B. | Ca2+、Al3+、Br-、NO3- | ||
| C. | Na+、ClO-、SO42-、HCO3- | D. | Mg2+、Cl-、NH4+、SO42- |
分析 常温下,由水电离出的c(H+)=1×10-14 mol/L的溶液中存在大量氢离子或氢氧根离子,
A.四种离子之间不反应,都不与氢离子和氢氧根离子反应;
B.钙离子、铝离子与氢氧根离子反应,硝酸根离子在酸性条件下能够氧化溴离子;
C.碳酸氢根离子能够与氢离子和氢氧根离子反应,次氯酸根离子与氢离子反应;
D.镁离子、铵根离子都与氢氧根离子反应.
解答 解:常温下,由水电离出的c(H+)=1×10-14 mol/L的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.K+、Ba2+、NO3-、Cl-之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.Ca2+、Al3+能够与氢氧根离子反应,Br-、NO3-在酸性条件下能够发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.ClO-、HCO3-能够与氢离子反应,HCO3-还能够与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Mg2+、NH4+与氢氧根离子反应,在碱性溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| A. | 将混合气体通过盛有浓硫酸的洗气瓶 | |
| B. | 将混合气体通过盛有水的洗气瓶 | |
| C. | 将混合气体通过盛有足量溴水的洗气瓶 | |
| D. | 将混合气体通过盛有澄清石灰水的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
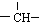 和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.
和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO2 | B. | NaClO4 | C. | HClO | D. | NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
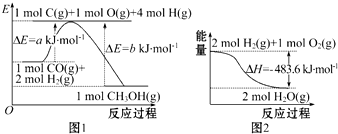
| A. | 根据图1可知合成甲醇的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者△H小 | |
| C. | 图2表示2 mol H2(g)所具有的能量比2 mol气态水所具有的能量多483.6 kJ | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+CuSO4═ZnSO4+Cu | B. | 2HI+Cl2═I2+2HCl | ||
| C. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | D. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com