
 .
.分析 (1)W、X是金属元素,W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,则W为Na,X为Al;
(2)W与Y可形成化合物W2Y,则Y是非金属硫,该化合物为硫化钠,硫化钠为离子化合物,阴阳离子需要标出所带电荷;
(3)硝酸铝为强酸弱碱盐,铝离子部分水解,溶液显酸性;
(4)Y、Z是非金属元素,Y的低价氧化物通入Z单质的水溶液中,则Z为Cl,二氧化硫和氯气反应生成盐酸与硫酸;
(5)非金属性越强,气态氢化物越稳定;
(6)离子的电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小.
解答 解:在短周期元素中,第二周期和第三周期的前面元素是金属,后面元素是非金属,
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,则W是金属钠,X是金属铝,氢氧化铝是两性氢氧化物,能和强碱反应生成盐和水,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)W与Y可形成化合物W2Y,则Y是非金属硫,硫化钠使钠离子和硫离子间通过离子键形成的离子化合物,电子式为:
故答案为:
(3)X为Al,其硝酸盐为硝酸铝,铝离子在溶液中部分水解:Al3++3H2O═Al(OH)3+3H+,溶液显示酸性,
故答案为:酸;Al3++3H2O═Al(OH)3+3H+;
(4)Y、Z是非金属元素,Y的低价氧化物通入Z单质的水溶液中,则Z为Cl,二氧化硫和氯气反应生成盐酸与硫酸,该反应为:SO2+C12+2H2O═H2SO4+2HCl,
故答案为:SO2+C12+2H2O═H2SO4+2HCl;
(5)原子的得电子能力越强,则氢化物的稳定性越强,同一周期从左到右原子的得电子能力逐渐增强,所以稳定性:HCl>H2S,
故答案为:HCl;H2S;
(6)微粒电子层越多半径越大,同电子层的微粒,则核电荷数越大离子半径越小,所以离子半径大小顺序为:S2->Cl->Na+>Al3+,
故答案为:S2-;Cl-;Na+;Al3+.
点评 本题考查位置、结构、性质的关系的综合应用,题目难度中等,熟悉第三周期元素的性质变化规律及常见元素的单质和化合物的性质是解答本题的关键,试题培养了学生灵活应用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式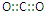 | |
| B. | CCl4的比例模型: | |
| C. | 含有18个中子的氯原子的核素符号:${\;}_{17}^{35}$Cl | |
| D. | 硫原子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠能用作供氧剂 | |
| B. | 氯化钠可用作净水剂 | |
| C. | 味精可用作食品添加剂 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
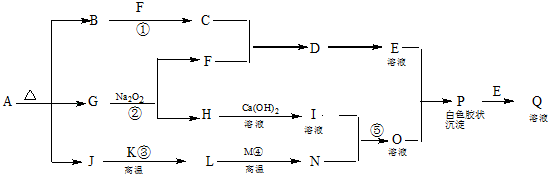
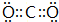 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去溶液中Ag+加盐酸盐比硫酸盐好 | |
| B. | 加入H20,溶解平衡不移动 | |
| C. | 用NaCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失 | |
| D. | 反应2AgCl+Na2S═Ag2S+2NaCl 说明溶解度:AgCl>Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其1支加入少量MnO2,可以研究催化剂对H2O2分解速率的影响 | |
| C. | 热稳定性:HF>HC1>HBr>HI | |
| D. | 中和pH与体积均相同的盐酸和醋酸溶液消耗NaOH的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

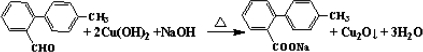 .
. 与
与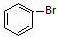 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: .
.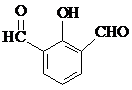 、
、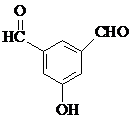 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的密度随着原子序数的增大而增大 | |
| B. | 碱金属单质都是银白色金属 | |
| C. | 在周期表中金属与非金属的分界处,可以找到半导体材料 | |
| D. | 所有气体单质都含有非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com