

分析 (1)电解氯化钠溶液时,阳极附近是Cl-放电,生成氯气,阴极附近时H+放电生成氢气,由于装置中放置了阳离子交换膜,所以在阴极生成NaOH,以此解答该题;
(2)离子交换膜法以石墨为电极电解饱和硫酸钠溶液,阳极发生4OH--4e-=2H2O+O2↑,阴极发生2H++2e-=H2↑,由图可知,左侧为阳极,右侧为阴极,从F口可不断充入Na2SO4,B为氧气;A为H2SO4溶液,C为氢气,D口流出的溶液为NaOH.
解答 解:(1)电解氯化钠溶液时,根据离子移动,则电极1为阳极,应连接电源的正极,阳极附近是Cl-放电,生成氯气,所以b口排出的是氯气,电极2为阴极,阴极附近时H+放电生成氢气,剩余氢氧根离子,由于装置中放置了阳离子交换膜,所以在阴极生成NaOH,即从d口流出;在实际生产中,为了增强溶液的导电性,又不影响NaOH纯度,所以纯水要加入一定量的NaOH溶液,
故答案为:d; Cl2 ;正; 增强溶液的导电性,不影响NaOH纯度;
(2)惰性电极电解饱和硫酸钠溶液,从F口可不断充入Na2SO4,阳极发生4OH--4e-=2H2O+O2↑,B为氧气;A为H2SO4溶液,所以a为阴离子交换膜,阴极发生2H++2e-=H2↑,C为氢气,所以从D口流出的溶液为NaOH,
故答案为:阴;NaOH.
点评 本题考查氯碱工业及电解原理,明确发生的离子反应及电解反应电极判断是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑧⑨ | B. | ⑤⑦⑧⑨⑩ | C. | ②③④⑤⑦ | D. | ①⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 周期表中前四周期元素R、W、X、Y、Z 的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z 的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和足量稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸钙和稀硝酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 稀硫酸和Ba(OH)2溶液反应:Ba2++H++SO42-+OH-═BaSO4↓+H2O | |
| D. | Cl2和FeCl2溶液反应:Cl2+Fe2+═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应20s,C的平均反应速率v(C)=0.005mol•L-1•s-1 | |
| B. | 反应平衡时,v(CO2):v(CO)=1:2 | |
| C. | 升高温度时,正反应速率增大,逆反应速率减小 | |
| D. | 充入N2使体系压强增大,能提高反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=2的溶液:K+、Na+、CH3COO-、CO32- | |
| B. | 与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3-、NO3- | |
| C. | 使酚酞呈红色的溶液中:Na+、K+、SiO32-、AlO2- | |
| D. | FeBr2溶液中滴加KI淀粉溶液变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
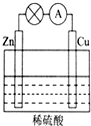 (1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
(1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com