
| A����HAΪ���ᣬBOHΪ�������C(H��)+C(B��)===C(OH��)+ C(A��) |
| B����HAΪǿ�ᣬBOHΪ�������C(A��)��C(B��) ��C(H��) ��C(OH��) |
| C����HAΪ���ᣬBOHΪǿ�����C(B��) ��C(A��) ��C(OH��) ��C(H��) |
| D����HAΪǿ�ᣬBOHΪǿ�����C(H��)= C(A��)= C(B��)= C(OH��)=0.1mol��L��1 |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��2H2(g)+O2(g) = 2H2O(1)��H�� �D285.8kJ��mol |
| B��2H2(g)+ O2(g) = 2H2O(1)��H�� +571.6 kJ��mol |
| C��2H2(g)+O2(g) = 2H2O(g)��H�� �D571.6 kJ��mol |
D��H2(g)+ 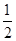 O2(g) = H2O(1)��H�� �D285.8kJ��mol O2(g) = H2O(1)��H�� �D285.8kJ��mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1.7�������� | B��2 | C��12 | D��12.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 =10-12������������Һ�������ϣ�������Һ���������ʵ���Ũ�ȹ�ϵ����ȷ����( )
=10-12������������Һ�������ϣ�������Һ���������ʵ���Ũ�ȹ�ϵ����ȷ����( )�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
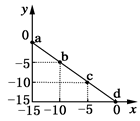
| A�����¶ȸ���25�� |
| B��ͼ��a����Һ�ʼ��� |
| C�����¶��£�0.01 mol��L��1��HCl��Һ��pH=2 |
| D�����¶��£�0.01 mol��L��1��NaOH��Һ��pH=12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
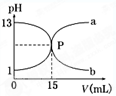
| A����������ʵ���Ũ��Ϊ1 mol/L |
| B��P��ʱ��Ӧǡ����ȫ����Һ������ |
| C������a������ζ��������Ƶĵζ����� |
| D����̪����������ʵ���ָʾ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
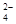 )��c(H��)ԼΪ(����)��
)��c(H��)ԼΪ(����)��| A��1��1 | B��1��2 | C��1��10 | D��10��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��[Na+]��[S2-]��[OH-]��[HS-]��[H+] |
| B��[Na+]+[H+]==[S2-]+[HS-]+[OH-] |
| C��[Na+]==[HS-]+2[H2S]+2[S2-] |
| D��[OH-]==[H+]+[HS-]+[H2S] |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com