
分析 (1)工业上将氯气通入到石灰乳中在制取漂白粉,氯气与碱反应生成金属氯化物和次氯酸盐;
(2)次氯酸盐是漂白杀毒剂的有效成分;
(3)次氯酸钙可以和空气中的水及二氧化碳反应生成具有漂白作用的次氯酸.
解答 解:(1)氯气与碱反应生成金属氯化物和次氯酸盐,工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,氯气和石灰乳
[Ca(OH)2]反应生成氯化钙和次氯酸钙以及水,方程式为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,
故答案为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;
(2)次氯酸盐是漂白杀毒剂的有效成分,漂白粉的有效成份是Ca(ClO)2,
故答案为:Ca(ClO)2;
(3)家庭生活中漂白粉的漂白原理是:次氯酸钙与空气中的水和CO2作用生成的次氯酸是一种很好的杀菌消毒剂,反应方程式如下:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
点评 本题考查学生对教材的记忆情况,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 生成N2为5.6L | |
| B. | 有0.3mol NO 被还原 | |
| C. | 生成氧化产物4.2g | |
| D. | 原混合物中NO 和NH3的物质的量之比可能为3:22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都可以从煤焦油中获得 | |
| B. | 乙烯和苯都是平面结构,因为二者分子中都含有碳碳双键 | |
| C. | 乙烯和苯都能使溴水褪色,且褪色的原因相同 | |
| D. | 乙烯和苯都能与H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的密度不再改变 | |
| B. | 混合气体中A的体积分数不再变化 | |
| C. | 混合气体的总压不再变化 | |
| D. | 单位时间内生成a mol A,同时生成2a mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
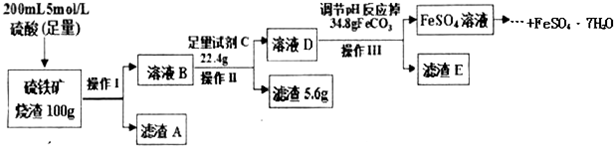
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
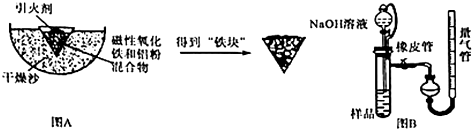
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯酸可以发生取代反应 | |
| B. | 丙烯酸可以使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯酸与HBr发生加成反应只能得到唯一产物 | |
| D. | 丙烯酸钠溶液中Na+浓度大于丙烯酸根离子浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②③⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
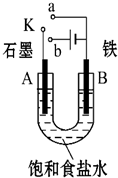 某课外活动小组用如图装置进行实验,试回答下列问题.
某课外活动小组用如图装置进行实验,试回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com