
| A. | 0.2mol | B. | 0.1mol | ||
| C. | 小于0.1mol | D. | 大于0.1mol,小于0.2mol |
分析 反应达到平衡时,PCl5为0.2mol,因体积、温度不变,移走反应物的物质的量为起始的一半,若平衡不移动,平衡时PCl5的物质的量为0.1mol,但由pV=nRT可知,n减小、压强减小,结合压强对平衡移动的影响来解答.
解答 解:移走反应物的物质的量为起始的一半,若平衡不移动,平衡时PCl5的物质的量为0.1mol,
但由pV=nRT可知,n减小、压强减小,
该反应为气体体积减小的反应,减小压强,平衡逆向移动,则达到新平衡时,PCl5的物质的量小于0.1mol,
故选C.
点评 本题考查化学平衡,为高频考点,把握压强与物质的量的关系、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意静态变化与动态变化的结合,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
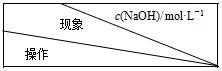 | 5.0 | 6.0 | 7.0 |
| 实验Ⅰ:滴入几滴KSCN溶液 | 不变红 | 不变红 | 不变红 |
| 实验Ⅱ:先加入过量稀硫酸,再滴入几滴KSCN溶液 | 不变红 | 变红 | 变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
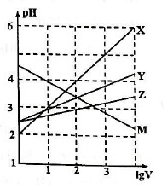 常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )
常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )| A. | X是HA,M是HB | |
| B. | 常温下PH:NaA溶液>NaB溶液 | |
| C. | 对于$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$的值(R代表A或B),一定存在HA>HB | |
| D. | 若常温下浓度均为0.1mol•L-1的NaA和HA的混合溶液的PH>7,则c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.
经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com