
����Ŀ����ѧʵ��������ͼ��ʾװ����ȡ�����屽������д���пհס�

��1������ƿa��װ���Լ��DZ��������м������b��������������һ�ǵ��������Ǽ���_______�����á�
��2����Ӧ�������ڵ���c���¿ڸ������Թ۲쵽�������֣��������ڷ�Ӧ���ɵ�________��ˮ�������γɵġ�
��3����Ӧ��Ϻ�����ƿd�е���AgNO3��Һ����________���ɡ�
��4����Ӧ��Ϻ���ƿa�е�Һ�嵹��ʢ����ˮ���ձ�����Թ۲쵽�ձ��ײ��к�ɫ������ˮ��Һ�塣�����ܽ�����Ĵ��屽,��ѡ���Լ� ��ȥ��
��5��д����ƿa�з�����Ӧ�Ļ�ѧ����ʽ��____________________________��
���𰸡���1������ ��2��HBr ��3������ɫ��������AgBr��������4������������Һ
![]()
�������������������1���������ӷ�������b�������⣬�����������������ã����ԭ�������ʡ�
��2���������ȡ����Ӧ���������屽�⣬�������廯�⣬�廯����ˮ�����γɰ�����
��3���廯������ˮ������������Ӻ���������Ӧ���ɵ���ɫ�廯��������
��4���������屽������ˮ�����ܶȴ���ˮ�ģ��������²㣬�ӷ������������屽�У������ձ��ײ��к�ɫ������ˮ��Һ�壬�����ܽ�����Ĵ��屽������������������Һ��ȥ��
��5���ڴ����������£������ϵ���ԭ�ӱ���ԭ����ȡ���������屽��ͬʱ���廯�����ɣ���Ӧ����ʽΪ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ�������14CO2��N218O��˵������ȷ����
A��������֮��Ϊ1 : 1 B��ԭ����֮��Ϊ1��1
C���ܶ�֮��Ϊ1 : 1 D��������֮��Ϊ1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������أ������й�˵����ȷ������ ��
A��ά����C���л�ԭ�ԣ�������������������
B�����ۡ���֬�͵����ʶ��Ǹ߷��ӻ�����
C������������ЧӦ���⻯ѧ�������γɶ��뵪���������й�
D������������ľ�����ά�����ڹ���ͨ�ŵĹ��ά�����л��߷��Ӳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ϩ����Ҫ���л�����ԭ�ϣ���ṹ��ʽΪCH2=C(CH3)CH=CH2��
���������գ�
��1��������X�������ϩ������ͬ�ķ���ʽ����Br/CCl4��Ӧ��õ�3-��-1,1,2,2-���嶡�顣X�Ľṹ��ʽΪ_______________��
��2�������ϩ��һ���Ʊ���������ͼ��ʾ��
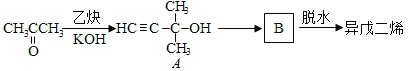
A�ܷ����ķ�Ӧ��___________�����Ӧ���ͣ�
B�Ľṹ��ʽΪ______________��
��3�����һ���������ϩ�Ƶ��л��ϳ��м���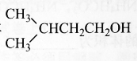 �ĺϳ�·�ߡ�
�ĺϳ�·�ߡ�
���ϳ�·�߳��õı�ʾ��ʽΪ��![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���������ݸ�Ŀʰ�š��м�����ҩ��335�֣����С�ǿˮ����Ŀ��д�����������ң���ʴ��𡭡���ˮ��ǿ������ʯ���ܴ��ڣ�Ω������ʢ��������ġ�ǿˮ����ָ
A����ˮ
B������
C����
D��±ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��﮷��������ȵ��װ����ͼ��ʾ�������ܷ�ӦΪxLi+LiVO8=Li1+xV3O8������ʱ����������������ط�Ӧʹ�������ڻ�������˵����ȷ���ǣ� ��
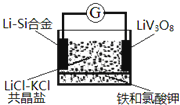
A��Li��Si�Ͻ�Ϊ���ȵ�ص�����
B����طŵ�ʱCl-����LiV308�缫
C��LiCl-KCl�����ο���LiCl��KCl�Ļ��ˮ��Һ����
D���ŵ�ʱ��������ӦʽΪLiV3O8+xLi++xe-=Li1+xV3O8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������������Ҫ�ɷ�Ϊ������������������������ȡ���Ĺ�����ͼ��ʾ��
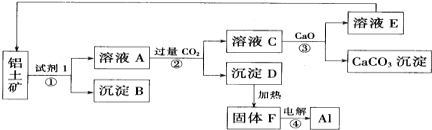
��1���Լ�1Ϊ______���ѧʽ�����١���ת��������_____�������������
��2������B�Ļ�ѧʽΪ______��
��3�����F����ת��6mol����ʱ�����Ƶ���______ g��
��4�����������У�������E����ѭ��ʹ���⣬������ѭ��ʹ�õ�������______���ѧʽ����
��5��д�����ӷ���ʽ����______�� �� ______��
��6��д����ѧ����ʽ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������þ��ͭ��ɵĻ������뵽ϡ�����У�������ȫ�ܽ������跴Ӧ�л�ԭ����ֻ��NO������Ӧ�����Һ�м���3 mol��L NaOH��Һ��������ȫ��������ɳ�����������ԭ�Ͻ����������5��1 g�������������в���ȷ���� �� ��
A�������ɵij������ﵽ���ʱ������NaOH��Һ�����V��100 mI��
B��������ȫ���ܽ�ʱ���μӷ�Ӧ����������ʵ���һ����0��4mol
C���μӷ�Ӧ�Ľ�����������Ϊ9��6 g��m��3��6 g
D��������ȫ���ܽ�ʱ�ռ���NO��������һ��Ϊ2�� 24 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��������ͼװ���Ʊ��������������۲�����ɫ���ṩ��ѧҩƷ����м��ϡ���ᡢ����������Һ��
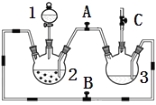
��1��ϡ����Ӧ���� ������д������������
��2����ʵ��ͨ������A��B��C�������أ��������еĿ����ž����ٹرտ��� ������ �Ϳɹ۲쵽��������������ɫ���Է���ʵ�鿪ʼʱ�ž�װ���п���������
��3��ʵ��ʱΪ��ֹ����2������ͨ�����ܽ�������3�У��ɲ�ȡ�Ĵ�ʩ�� ��
��4����FeSO4��Һ�м�����NH4��2SO4������Ʊ�Ħ���ξ���[��NH4��2SO4��FeSO4��6H2O] ����Է�������392�����þ����һ���������ȶ������ױ�������������ˮ���������Ҵ���
��Ϊϴ����NH4��2SO4��FeSO4��6H2O�ֲ�Ʒ�����з���������ʵ���
A������ˮϴ B��������ˮϴ��������ˮ�Ҵ�ϴ
C����30%���Ҵ���Һϴ D����90%���Ҵ���Һϴ
��Ϊ�˲ⶨ��Ʒ�Ĵ��ȣ���ȡa g��Ʒ����ˮ�����Ƴ�500mL��Һ����Ũ��Ϊc mol��L-1������KMnO4��Һ�ζ���ÿ����ȡ����Һ�����Ϊ25��00mL��ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ����� | ������ |
���ĸ��������Һ���/mL | 25��52[ | 25��02 | 24��98 |
�ζ������з�����Ӧ�����ӷ���ʽΪ
�ζ��յ��������
ͨ��ʵ�����ݼ���ĸò�Ʒ����Ϊ ������ĸac��ʾ�����ϱ��е�һ��ʵ���м�¼�������Դ��ں����Σ���ԭ�������
A��ʵ�����ʱ���ӿ̶��߶�ȡ�ζ��յ�ʱ���Ը��������Һ�����
B���ζ�ǰ�ζ��ܼ��������ݣ��ζ�����������
C����һ�εζ��õ���ƿ�ô�װҺ��ϴ����������δ��ϴ
D�������Ը�����ر�Һ����ʱ��������в��ֱ��ʣ�Ũ�Ƚ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com