
将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: NH2COONH4(s) 2NH3(g)+CO2(g);不能判断该分解反应已经达到平衡的是:( )
2NH3(g)+CO2(g);不能判断该分解反应已经达到平衡的是:( )
A.密闭容器中氨气的浓度不变 B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.2v(NH3)=v(CO2)
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
对反应 4NH3 + 5O2 = 4NO + 6H2O,下列反应速率的最快的是
A. v(NH3)=0.25 mol·L-1·min-1 B. v(O2)=0.35mol·L-1·min-1
C. v(NO)=0.01 mol·L-1·S-1 D. v(H2O)=0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠溶液与稀硫酸的反应方程式为:
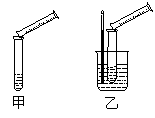 Na2S2O3+H2SO4 = Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。
Na2S2O3+H2SO4 = Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。
(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究 对化学反应速率的影响。
(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
| 实验 组号 | 温度 | Na2S2O3溶液 | H2SO4 | 加入H2O的体积 | 出现沉淀所需时间 | ||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| Ⅰ | 0℃ | 5mL | 0.1mol·L—1 | 10mL | 0.1mol·L—1 | 5mL | 8s |
| Ⅱ | 0℃ | 5mL | 0.1mol·L—1 | 5mL | 0.1mol·L—1 | 10mL | 12s |
| Ⅲ | 30℃ | 5mL | 0.1mol·L—1 | 5mL | 0.1mol·L—1 | 10mL | 4s |
结论1:由Ⅰ和Ⅱ两组数据可知 ;
结论2:由Ⅱ和Ⅲ两组数据可知 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图表示4个碳原子相互结合的几种方式。小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是:

A.图中属于烷烃的是A、C、H
B.图中与B互为同分异构体的有E、F、H
C.图中物质碳元素的质量分数最大的是C
D. 图中C和F分子中氢原子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
| 实验 装置 |
|
|
|
|
| 部分实验现象 | a极质量减小b极质量增加 | c极有气体产生 b极质量减轻 | d极溶解c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A. a>b>c>d B. b>c>d>a
C. d>a>b>c D. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
目前人类已发现的非金属元素除稀有气体外,共16种。对这16种元素的相关判断:①都是主族元素,最外层电子数都大于4,②单质在反应中都只作氧化剂,③氢化物常温下都呈气态,④氧化物常温下都可以与水反应生成酸,其中不正确的是( )
A.只有①② B.只有①③
C.只有③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,属于加成反应的是
A.苯酚与饱和溴水反应生成三溴苯酚 B.乙酸与乙醇反应制取乙酸乙酯
C.甲烷与氯气反应制取一氯甲烷 D.乙烯与氯化氢反应制取氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
如何降低大气中CO2的含量及有效地开发利用CO2,已引起了全世界的普遍重视。“低碳经济”正成为科学家研究的主要课题。
(1)已知: ① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式 。
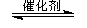 (2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在下图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
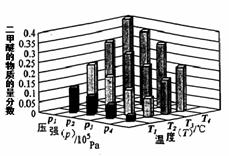
②某温度下,将2.0molCO2(g)和6.0mol(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是 ;
A. P3>P2,T3>T2 B. P1>P3,T1>T3
C. P2>P4,T4>T2 D. P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
A. 正反应速率先增大后减小 B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大 D. 反应物的体积百分含量增大
E. 混合气体的密度减小 F. 氢气的转化率减小
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇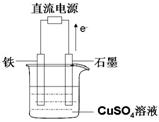 燃料电池负极反应式____ 。以此燃料电池作为外接电源按右图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 g。
燃料电池负极反应式____ 。以此燃料电池作为外接电源按右图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com