
| A. | 水溶液都显碱性 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | NaHCO3比Na2CO3更易溶于水 | |
| D. | 与足量盐酸反应得到等量的CO2时,消耗NaHCO3的质量比Na2CO3的质量要少 |
分析 NaHCO3不稳定,溶解度比Na2CO3小,与盐酸反应较Na2CO3剧烈,可与NaOH反应生成Na2CO3,Na2CO3可与水、二氧化碳反应生成NaHCO3,以此解答该题.
解答 解:A、Na2CO3和NaHCO3都是强碱弱酸盐,水溶液呈碱性,故A正确;
B、因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,故B正确;
C、碳酸钠的溶解度大于碳酸氢钠,所以Na2CO3比NaHCO3更易溶于水,故C错误;
D、与足量盐酸反应得到等量的CO2时,根据碳守恒,消耗NaHCO3和Na2CO3的物质的量相等,最终生成氯化钠,再结合氯守恒,所以面碳酸钠消耗盐酸多,故D正确;
故选C.
点评 本题考查碳酸钠与碳酸氢钠的性质,明确发生的化学反应是解答本题的关键,并注意利用稳定性、与酸的反应、水解、与碱的反应来分析解答.


科目:高中化学 来源: 题型:实验题
 Ⅰ.按图装置进行实验,并回答下列问题.
Ⅰ.按图装置进行实验,并回答下列问题. Ⅱ.(1)电工经常说的一句口头禅:“铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:铜与铝连接会构成原电池,其中铝为原电池的负极,铜为原电池的正极.构成原电池后,铝的腐蚀速度大大加快,电阻增大,放热增多,时间长了,有可能引发火灾.
Ⅱ.(1)电工经常说的一句口头禅:“铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:铜与铝连接会构成原电池,其中铝为原电池的负极,铜为原电池的正极.构成原电池后,铝的腐蚀速度大大加快,电阻增大,放热增多,时间长了,有可能引发火灾.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 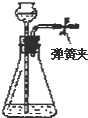 长颈漏斗内液面高度保持不变 | |
| B. | 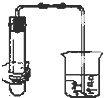 双手移去后.导管中水面与烧杯水面相平 | |
| C. | 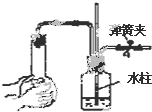 长导管内形成一段水柱 | |
| D. | 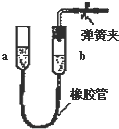 上移a管后,a、b两端液面形成了一段稳定的高度差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
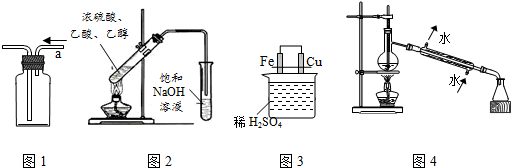
| A. | 用图1所示装置从a口进气可收集CH2=CH2 | |
| B. | 用图2所示装置制取并收集乙酸乙酯 | |
| C. | 用图3所示装置比较Fe、Cu的金属活动性 | |
| D. | 用图4所示装置进行石油的蒸馏实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA | |
| B. | 常温常压下,8.8g CO2和N2O的混合气体所含电子数为4.4 NA | |
| C. | 常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH-,0.02NA | |
| D. | 1 L 1 mol/L的乙醇水溶液中含有氢原子总数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
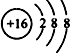 .
.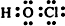 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,14g CO和N2的混合物含的原子数为NA | |
| B. | 1mol Fe发生氧化反应失去的电子数一定是3NA | |
| C. | 0.1mol•L-1 NaCl溶液中含的Cl-数是0.1NA | |
| D. | 0.1mol H2SO4与1L 0.1mol•L-1 NaOH溶液反应,生成的H2O分子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
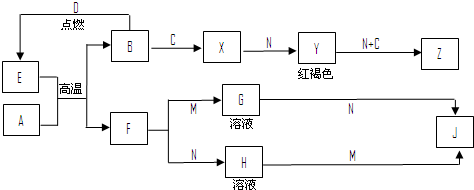
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com