
某同学设计可如图所示的探究原电池的装置.下列有关说法正确的是
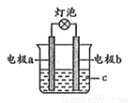
A.电极材料必须是金属材料
B.若a极为铜条、b极为锌片,c为蔗糖溶液时,灯泡会发亮
C.若a极为铝条、b极为铜片,c为浓硝酸溶液时,铜为负极
D.若a极为铝条、b极为镁片,c为稀硫酸溶液时,铝为负极
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:2016届吉林省高三上学期二次模拟测试理综化学试卷(解析版) 题型:选择题
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是60 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第一次月考化学试卷(解析版) 题型:选择题
工业上制备氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下: CuO+2HCl=CuCl2+H2O;FeO+2HCl=FeCl2+H2O。已知: 当pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀; pH≥6.4时, Cu2+以Cu(OH)2形式完全沉淀;pH在3~4时, Fe3+以Fe(OH)3形式完全沉淀。除去溶液中的Fe2+可以采用的方法是
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化Fe3+成再调整pH至3~4
D.通入硫化氢,使Fe2+直接沉淀
查看答案和解析>>
科目:高中化学 来源:2016届山西省校高三上学期阶段性考试化学试卷(解析版) 题型:选择题
某温度下,将C12通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定NaClO与NaClO3的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21:5 B. 11:3 C.3:1 D.4:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上学期10月月考化学试卷(解析版) 题型:选择题
下列各项中的两个量,其比值一定为2∶1的是
A.在相同温度下,等浓度的H2SO4和CH3COOH溶液中的c(H+)
B.相同温度下,0.2 mol·L-1醋酸溶液和0.1 mol·L-1醋酸溶液中的c(H+)
C.相同温度下,等浓度的Ba(OH)2和NaOH溶液,前者与后者的c(OH-)
D.液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积
查看答案和解析>>
科目:高中化学 来源:2016届福建省四地六校高三上学期第一次联考化学试卷(解析版) 题型:选择题
新型纳米材料氧缺位铁酸盐(MFe2Ox )(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质.转化流程如图所示:有关上述转化过程的下列叙述正确的是
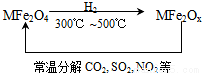
A.MFe2O4表现了还原性 B.MFe2Ox表现了还原性
C.SO2和NO2表现了还原性 D.SO2和NO2发生了分解反应
查看答案和解析>>
科目:高中化学 来源:2016届广西省高三上学期第一次月考理综化学试卷(解析版) 题型:选择题
下列关于反应能量的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)ΔH=-216 kJ·mol-1,反应物总能量<生成物总能量
B.相同条件下,1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2
C.已知2H2(g)+O2(g)= 2H2O(g)ΔH=-483.6 kJ·mol-1, H2的燃烧热为241.8 kJ·mol-1
D.H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1,含1 mol NaOH的NaOH溶液与含
0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第一次检测化学试卷(解析版) 题型:填空题
(12分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- ,
(2)由第二份进行的实验可知混合物中应含 离子,其物质的量浓度为 。
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量 。
(4)综合上述实验,你认为以下结论正确的是
A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol
B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl-
C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl-
D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期期中考试理综化学试卷(解析版) 题型:选择题
将4molA(g)和2molB(g)在2L的恒容密闭容器中混合并在一定条件下发生如下反应::2A(g)+B(g) 2C(g),△H<0;反应2s后测得C的浓度为0.6mol/L.下列说法中正确的是
2C(g),△H<0;反应2s后测得C的浓度为0.6mol/L.下列说法中正确的是
A.2s后物质A的转化率为70%
B.达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K减小
C.达到平衡状态时,增加A物质的量,A和B转化率都提高
D.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com