
����Ŀ��a��b��c��d��e���ֶ�����Ԫ�ص�ԭ������������aΪ�ǽ���Ԫ�أ���a��eͬ���壬c��dΪͬ���ڵ�����Ԫ�أ�eԭ�ӵ�����������c��dԭ������������֮�ͣ�bԭ���������������ڲ��������2����c����̬�⻯���������3�����ۼ������ƶϣ�
��1��д��bԪ�������ڱ��е�λ����
��2��д��һ����a��c��d���γɵ����ӻ���������ѧʽ��������e������������Ӧˮ�������Һ����ʱ��Ӧ�����ӷ���ʽ����
��3��c�ĵ��ʵĵ���ʽΪ ��
��4��b�������̬�⻯��Ľṹʽ��
��5��b��d��ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ����������ʵ��֤����һ���۵�����ѡ����ĸ��ţ���
A�������£�b�ĵ��ʳʹ�̬��d�ĵ��ʳ���̬
B��d���⻯����ȶ���ǿ��b���⻯��
C��b��d�γɵĻ������У�b������
D��d���⻯��ķе����b���⻯�
���𰸡�
��1���ڶ����ڢ�A��
��2��NH4NO3��NH4++OH�� ![]() ?NH3��+H2O
?NH3��+H2O
��3��![]()
��4��![]()
��5��O��BC
���������⣺a��b��c��d��e���ֶ�����Ԫ�ص�ԭ������������bԭ���������������ڲ��������2����ԭ��ֻ����2�����Ӳ㣬����������Ϊ4����bΪCԪ�أ�c���⻯���������3�����ۼ�����c���ڢ�A�壬c��dΪͬ���ڵ�����Ԫ�أ�d���ڢ�A�壬eԭ�ӵ�����������c��dԭ������������֮�ͣ���e��������=5+6=11����eΪNa��aΪ�ǽ���Ԫ�أ���a��eͬ���壬��aΪHԪ�أ����ԭ��������֪��c��dֻ�ܴ��ڵڶ����ڣ���cΪNԪ�ء�dΪOԪ��.
��1.��bΪCԪ�أ��������ڱ��еڶ����ڢ�A�壬���Դ��ǣ��ڶ����ڢ�A�壻
��2.����H��N��O�γɵ����ӻ�����Ϊ��NH4NO3 �� e������������Ӧˮ����ΪNaOH������������Һ��������ڼ��������·������ӷ�Ӧ���ɰ�����ˮ����Ӧ���ӷ���ʽΪNH4++OH�� ![]() NH3��+H2O�����Դ��ǣ�NH4NO3��NH4++OH��
NH3��+H2O�����Դ��ǣ�NH4NO3��NH4++OH�� ![]() NH3��+H2O��
NH3��+H2O��
��3.��bΪ̼Ԫ�أ��������̬�⻯��Ϊ���飬��ṹʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��
��4.��c�ĵ���ΪN2 �� ������Nԭ��֮���γ�3�Թ��õ��Ӷԣ�����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��
��5.��bΪ̼Ԫ�ء�dΪ��Ԫ�أ�C��Oͬ���ڣ���ԭ����������ǽ����Լ������ʷǽ�����O��C��
A�����ʵ�״̬�����������ʣ����ܱȽϷǽ����ԣ���A����
B��d���⻯����ȶ���ǿ��b���⻯�˵���ǽ�����dǿ����B��ȷ��
C��b��d�γɵĻ������У�b�����ۣ�˵��d�Լ��ϵ��ӵ�������ǿ����d�ķǽ����Ը�ǿ����C��ȷ��
D���е������������ʣ����ܱȽϷǽ�����ǿ������D����
���Դ��ǣ�O��BC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NO��CO2��N2O4�������壬���Ƿֱ���0.5mol��ԭ�ӣ���������������ʵ���֮��Ϊ�� ��
A.1��1��2
B.1��1��1
C.4��2��1
D.1��2��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֳ�������θ��ҩƷ�ı�ǩ��

���������������� ���������� ��
������ҩƷ�����������ʾ����к�θ����������ᡣ
��1����д��3��ҩƬ����Ч�ɷ������ᷴӦ�����ӷ���ʽ��
��_________________________________________________________________________��
��_________________________________________________________________________��
��_________________________________________________________________________��
��2����θ����Ļ��߲��ܷ���ҩƬ�٣�ԭ����___________________________________________________��
��3��ij���߷���ҩƬ��2Ƭ�����������������û��߷��ø�ҩƬ2Ƭ�����������Լ______________mL�����������״�����㣩
��4�����й�������ҩƬ�к�θ��������Ƚϣ���ȷ����_______________��
A������������ B������������ C������������ D������������
��5������ÿƬҩƬ�к�θ�����������ҩЧ����ÿ����ҩƬ��1Ƭ���൱�ڷ���ҩƬ��________________________Ƭ������ȷ��С�����һλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1molAl2(SO4)3��350mL2mol/LNaOH��Һ��ϣ����ó���������Ϊ
A��78g B��15.6g C��7.8g D��3.9g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0��10mol��L��1NaOH��Һ�ֱ�ζ�20��00mLŨ�Ⱦ�Ϊ0��10 mol��L��1CH3COOH
��Һ��HCN��Һ���õζ���������ͼ������˵����ȷ����

A. �����͵�����ʾ��Һ�У�c��CH3COO������c��CN����
B. �����͵�����ʾ��Һ�У�c��Na������c��OH������c��CH3COO������c��H����
C. �����͵�����ʾ��Һ�У�c��CH3COO������c��CN������c��HCN����c��CH3COOH��
D. �����͵�����ʾ��Һ�ж��У�c��CH3COO������c��OH������c��CH3COOH����c��H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Ksp(AgC1)=1.56��10-10,Ksp(Ag2CrO4)=9.0��10-12,����˵����ȷ����
A. ��ͬŨ�ȵ�Na2CrO4��NaC1�����Һ�еμ�AgNO3��Һ,AgCl������
B. ��AgCl������ƣ�м���NaCl���壬��AgCl��������Һ��cCl-)=c(Ag+)
C. AgCl��Ag2CrO4���������Һ�У� 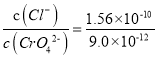
D. ��Ag2CrO4����Һ�м���NaClŨ��Һ��Ag2CrO4������ת��ΪAgCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2���ȶ����ֽ⣬Fe3+��Cu2+�ȶ���ֽ�������ã�Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����ij��ѧ�о�С��ͬѧ�ֱ������ͼ1��ͼ2����ʵ��װ�ã� 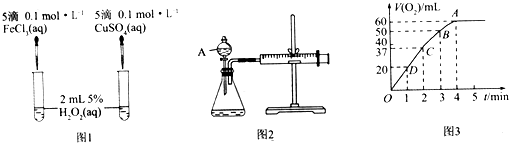
��1��������ͼ1ʵ�飬��ͨ���۲�������ݵĿ������ԱȽϵó����ۣ���ͬѧ�����FeCl3��ΪFe2��SO4��3��Ϊ�������������� �� д��H2O2�ڶ������̴������·�����Ӧ�Ļ�ѧ����ʽ�� �� ������ͼ2ʵ��ɽ��ж���������ͼ������A������Ϊ �� ʵ��ʱ��������40mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�ʵ���л���Ҫ������������ ��
��2����0.1mol MnO2��ĩ����50mL H2O2��Һ�У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ3��ʾ�����ͷ�Ӧ���ʱ仯��ԭ�� �� H2O2��ʼ���ʵ���Ũ��Ϊ��������λ��Ч���֣���
��3��Ϊ�˼���ͬѧ�Ƕ�Ӱ�췴Ӧ�������ص���ʶ����ʦ��ͬѧ�������ʵ�飺
������ʵ��װ�õ���ƿ�ڼ���6.5gп����ͨ����Һ©������40mL 2.5molL��1�����ᣬ10sʱ�ռ���������H2�����Ϊ44.8mL����״�������������ʾ10s�ڸ÷�Ӧ������ΪmolL��1s��1�����跴Ӧǰ����Һ��������䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؾ����˵������ȷ����
A. ԭ�Ӿ����У����ۼ�Խǿ���۵�Խ��
B. ���ۻ�ʱ��ˮ�����й��ۼ���������
C. �Ȼ�������ˮ�ܵ����H����Cl���������Ȼ��������Ӿ���
D. �⾧������ת��ɵ����������յ��������ڿ˷���ԭ�Ӽ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ˮ�м�������CCl4�������ú�۲쵽��������
A. �γɾ��ȵ���ɫ��Һ
B. �γɾ��ȵ��Ϻ�ɫ��Һ
C. Һ��ֲ㣬�²���Ϻ�ɫ
D. Һ��ֲ㣬���²������ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com