
| A、稀硫酸中:K+、Mg2+、AlO2-、S2O32- | ||
| B、NaHS溶液中:SO42-、K+、Cl-、Cu2+ | ||
C、
| ||
| D、通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |


科目:高中化学 来源: 题型:
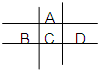 图为周期表的一小部分,A、B、C、D的位置关系如图所示.且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:
图为周期表的一小部分,A、B、C、D的位置关系如图所示.且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在25℃时,任何水溶液中KW=1×10-14 |
| B、在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-) |
| C、在PH=2的盐酸酸化的FeCl3溶液,稀释至10倍,则溶液PH=3 |
| D、0.1mol?L-1醋酸溶液中加入冰醋酸,平衡正向移动,醋酸的电离程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、Cl-、SO42- |
| B、Al3+、Na+、NO3-、SO42- |
| C、Na+、K+、CO32-、SO42- |
| D、Na+、K+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电解初期,石墨电极上有H2产生 | ||||
| B、整个电解过程中,H+的浓度不断增大 | ||||
| C、电解一定时间后,石墨电极上有铜析出 | ||||
D、电解初期,总反应方程式为:Cu+H2SO4
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫气体通入到漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B、碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
| C、H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑ |
| D、向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2O含有的分子数为 NA |
| B、常温常压下,1.70g NaNO3含有的Na+离子数为0.02 NA |
| C、通常状况下,0.5 NA 个CO分子占有的体积为11.2 L |
| D、物质的量浓度为0.5mol?L-1的MgBr2溶液中,含有Br-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、烧杯a中的溶液pH升高 |
| B、烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
| C、烧杯b中发生还原反应 |
| D、烧杯b中发生的反应为2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com