
【题目】下列叙述正确的是( )
A. 含有6.02×1023个氦原子的氦气在标准状况下的体积约为11.2L
B. 25℃,1.01×105Pa,64gSO2中含有的原子数为1.806×1024
C. 常温常压下,28g乙烯(C2H4)与丙烯(C3H6)混合物中含有的碳原子数为3NA
D. 标准状况下,11.2LH2O含有的分子数为3.01×1023
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】2016年10月17日,神州十一号飞船在酒泉卫星发射中心成功发射,根据太空的失重状况,下列化学实验在太空中无法完成的是
A. 过滤
B. 两种固体混合
C. 硫酸与氢氧化钠溶液的中和反应
D. 蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。
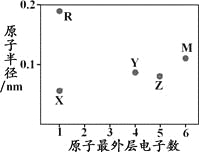
下列说法不正确的是
A. 简单阳离子半径:X< R
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. X与Y可以形成正四面体结构的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d9,该元素在周期表中的位置是( )
A.第三周期Ⅷ族,p区B.第三周期ⅤB族,d区
C.第四周期ⅠB族,ds区D.第四周期ⅤB族,f区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种充电电池放电时的电极反应为:H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-当为电池充电时,与外电源正极连接的电极上发生的反应是 ( )
A. Ni(OH)2的氧化 B. NiO(OH)的还原 C. H2的氧化 D. H2O的还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素电负性随原子序数的递增而增强的是( )
A. Na, K, Rb B. N, P, As C. O, S, Cl D. Si, P, Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压,相同体积的CO和C2H4具有相同的( )
①分子数 ②原子总数 ③碳原子数 ④质量
A. ①④ B. ②③ C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强。四种元素原子半径随原子序数的变化如图所示。下列说法正确的是( )

A. 简单离子半径:W>Y>X
B. 气态氢化物的稳定性:Z>W
C. 化合物YWX既含离子键,又含共价键
D. Z的氧化物能与W的气态氢化物水溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com