
【题目】化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
【答案】C
【解析】本题是有关盐的应用。首先要认识盐的组成、性质、然后通过与其它物质接触会发生什么反应、有何作用和影响。最后得到相应的结论。盐主要考查盐类知识的应用。主要是盐的水解。盐水解的规律是:有弱才水解,谁弱谁水解,谁强显谁性。都弱都水解,都强不水解。A、纯碱是强碱弱酸盐水解使溶液显碱性。盐的水解反应是吸热反应,所以升高温度,促进盐的水解,使溶液的碱性更强。油脂在碱性情况下水解产生容易溶解于水的高级脂肪酸的钠盐和甘油。因此用热的纯碱溶液可以更好地洗去油污。而不是碳酸钠与油污直接发生反应。错误。B、漂白粉是CaCl2和Ca(ClO)2的混合物。在空气中久置变质,是因为其有效成分Ca(ClO)2与空气中的H2O、CO2发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,产生的HClO不稳定,光照分解2HClO![]() 2HCl+O2↑.最后得到的固体是CaCl2和CaCO3的混合物而失去漂白性。错误;C、草木灰的有效成分K2CO3是强碱弱酸盐,水解使溶液显碱性,而NH4Cl是强酸弱碱盐,水解使溶液显酸性,当施肥时若把草木灰(有效成分为K2CO3)与NH4Cl混合使用,则二者的水解作用相互促进,发生的双水解反应的离子方程式为:CO32-+2NH4+= CO2↑+NH3↑ +H2O;这样N元素就会以氨气的形式逸出从而使肥效会降低。正确。D、FeCl3有强氧化性,能够与Cu在溶液发生氧化还原反应2FeCl3+Cu=2FeCl2+CuCl2,把多余的Cu腐蚀掉。因此可用于铜质印刷线路板的制作,并非发生置换反应。错误。
2HCl+O2↑.最后得到的固体是CaCl2和CaCO3的混合物而失去漂白性。错误;C、草木灰的有效成分K2CO3是强碱弱酸盐,水解使溶液显碱性,而NH4Cl是强酸弱碱盐,水解使溶液显酸性,当施肥时若把草木灰(有效成分为K2CO3)与NH4Cl混合使用,则二者的水解作用相互促进,发生的双水解反应的离子方程式为:CO32-+2NH4+= CO2↑+NH3↑ +H2O;这样N元素就会以氨气的形式逸出从而使肥效会降低。正确。D、FeCl3有强氧化性,能够与Cu在溶液发生氧化还原反应2FeCl3+Cu=2FeCl2+CuCl2,把多余的Cu腐蚀掉。因此可用于铜质印刷线路板的制作,并非发生置换反应。错误。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】CH3CH2CH=CH2是来自石油基本化工原料,现有如下转化关系:

己知:C为醛
(l)上述各步反应中所属反应类型分别为:______,______,______,______,______。
(2)A、B、C、D、G中官能团名称______,______,______,______,______。(官能团,是决定有机化合物的化学性质的原子或原子团。)
(3)B和D反应进行比较缓慢,请说出提高该反应速率的2种方法___________。
(4)写出属于醇但不能被O2催化氧化生成醛的B的所有同分异构体的结构简式________。
(5)写出除③外的各步反应的化学方程式:
① A→B:______________;
② B→C: ______________;
④ B+足量D→G: ______________;
⑤ G+ Na0H→B+E: ______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:

(1)常温下含氢量最高的烃是(填对应字母)________________;
(2)能够发生加成反应的烃有(填数字)________种;
(3)G与浓硝酸和浓硫酸的混酸共热生成的淡黄色晶体的名称(用系统命名法命名)__________;(不允许写简称)
(4)写出A失去一个氢原子形成的甲基的电子式______________________;
(5)写出F发生溴代反应的化学方程式:______________________
(6)写出实验室制取D的化学方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 金属的电化学腐蚀比化学腐蚀普遍
B. 钢铁在干燥的空气里不易腐蚀
C. 用铝质铆钉铆接铁板,铁板易被腐蚀
D. 原电池外电路电子由负极流入正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用HNO3 与大理石反应过程中质量减小的方法研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HN03 的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,在实验目的一栏中填出对应的实验编号:
试验编号 | T/K | 大理石规格 | HNO3浓度mol/L | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | 实验①和②探究HNO3 浓度对该反应速率的影响; (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①中CO2质量随时间变化的关系见图:

依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70~90s范围内HNO3的平均反应速率_______。(忽略溶液体积变化)
(3)请在上图中,画出实验②和③中CO2质量随时间变化关系的预期结果示意图,并标出线的序号_______。
(4)工业上己实现CO2和H2反应生成甲醇的转化。己知:在一恒温、恒容密闭容器中充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CO2和CH3OH (g)的浓度随时间变化如下图所示。请回答:
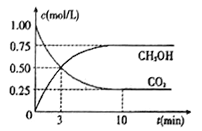
①达到平衡时H2的转化率为_______。在前10min内,用CO2表示的反应速率:V(CO2)=______mol/(L·min)
②能判断该反应达到化学平衡状态的依据是_______。
a.容器压强不变 b.混合气体中c(CO2)不变
c. v(CH3OH)=v(H2O) d. c(CH3OH)=c(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,在元素组成上最相似的一组是
A. 核糖、核糖核苷酸、脱氧核糖核酸
B. 乳酸、脂肪酸、丙酮酸
C. 性激素、胰岛素、抗体
D. 淀粉、淀粉酶、控制淀粉酶合成的基因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com