
分析 (1)铜、锌、稀硫酸构成原电池中,Zn失电子作负极,Cu为正极,氢离子在正极上得电子生成氢气;
(2)以石墨为电极,电解KI溶液时,在阴极上是氢离子得电子,阳极上是碘离子失电子;
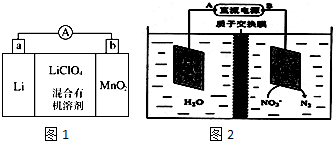
(3)形成原电池反应时,Li失电子为负极,MnO2为正极,外电路中电子从负极流向正极,电流与电子流向相反;
(4)硝酸根离子得电子生成氮气,则B相连的电极为阴极,所以B为负极,A为正极.
解答 解:(1)铜、锌、稀硫酸构成原电池中,Zn失电子作负极,Cu为正极,氢离子在正极上得电子生成氢气,则正极的电极反应为:2H++2e-=H2↑;
故答案为:锌;2H++2e-=H2↑;
(2)以石墨为电极,电解KI溶液时,在阴极上是氢离子得电子生成氢气,还生成氢氧根离子,加酚酞时,阴极附近变红色,阳极上是碘离子失电子生成碘单质,碘单质遇到淀粉会变蓝色;
故答案为:红;蓝;
(3)①形成原电池反应时,Li失电子为负极,即a 为负极,MnO2为正极,即b为正极,外电路中电子从负极流向正极,即电子从a流向b,则电流从b流向a,
故答案为:b;a;
②正极上MnO2被还原生成LiMnO2,则正极的电极方程式为:MnO2+e-+Li+=LiMnO2,
故答案为:MnO2+e-+Li+=LiMnO2;
(4)硝酸根离子得电子生成氮气,则B相连的电极为阴极,所以B为负极,A为正极,阴极上的反应为:2NO3-+10e-+12H+=6H2O+N2↑;
故答案为:A;2NO3-+10e-+12H+=6H2O+N2↑.
点评 本题侧重于电化学知识的全面考查,题目难度适中,能很好地考查学生的分析能力以及电化学知识的综合理解和运用,明确电解时离子的放电顺序及发生的电极反应是解答本题的关键.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
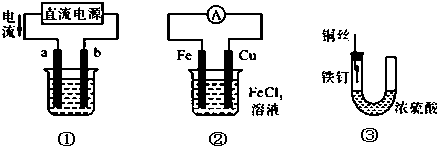
| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 用装置①进行电镀,镀件接在b极上 | |
| C. | 装置②的总反应是:Cu+Fe3+═Cu2++Fe | |
| D. | 装置③中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
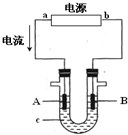 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5 OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次 | |
| D. | 容量瓶不能长期存放配制好的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
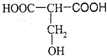 .
. +2H2O;
+2H2O;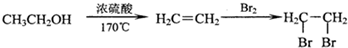
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com