
| A. | 第三周期第0族 | B. | 第四周期第ⅠA族 | C. | 第三周期第ⅠA族 | D. | 第三周期第ⅦA族 |
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯中的甲苯(溴水) | B. | 乙醇中的水(新制CaO) | ||
| C. | 乙醛中的乙酸(NaOH) | D. | 乙酸乙酯中的乙酸(饱和NaHCO3溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.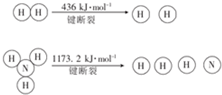
| n(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
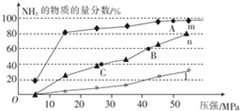
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的酯,F是一种高聚物,可制成多种包装材料.
已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的酯,F是一种高聚物,可制成多种包装材料.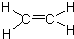 ,C的名称为乙醛.
,C的名称为乙醛.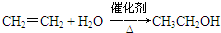 ④
④ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
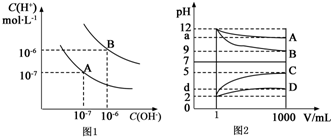
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Cu2+、NO3-、SO42- | B. | K+、Na+、SO42-、Cl- | ||
| C. | CO32-、H+、Na+、K+ | D. | H+、Cl-、NO3-、Ag+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com