
【题目】Ⅰ.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:____。
(2)实验②的化学反应中转移电子的物质的量是____。
Ⅱ.(3)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1mol O3转化为1mol O2和1mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是____(填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是____(用离子方程式表示)。
【答案】ClO-+2I-+2H+=I2+Cl-+H2O 0.004mol C ClO-+Cl-+2H+=Cl2↑+H2O
【解析】
Ⅰ、(1)次氯酸根离子具有氧化性,能将碘离子氧化为碘单质;
(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,反应的离子方程式为:H2O+I2+SO32-=SO42-+2I-+2H+,结合化合价升高值=化合价降低值=转移电子数分析计算;
Ⅱ、(3)根据Cl2、H2O2、ClO2、O3反应后生成物的价态分析转移的电子数,转移的电子越多,消毒效率越高;
(4)ClO-与浓盐酸中的Cl-会发生反应生成有毒的Cl2。
I、(1)实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子,反应离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;
(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,反应的离子方程式为:H2O+I2+SO32-=SO42-+2I-+2H+,设转移电子的物质的量为x。
H2O+SO32-+I2=SO42-+2I-+2H+ 转移电子
1mol 2mol
0.5mol/L×0.004L x
x=![]() =0.004mol,故答案为:0.004mol;
=0.004mol,故答案为:0.004mol;
II、(3)这些物质都为1mol时,Cl2(发生的反应为Cl2+H2O=HCl+HClO)、H2O2(分解生成氧气和水)、ClO2(反应生成氯离子)、O3(1 molO3转化为1 mol O2和1 mol H2O)消毒时,转移电子依次为1mol、1mol、5mol、2mol,等物质的量的上述物质反应,ClO2转移的电子数最多,消毒效率最高,故答案为:C;
(4)ClO-与浓盐酸中的Cl-会发生反应生成有毒的Cl2,方程式为ClO-+Cl-+2H+═Cl2↑+H2O,因此“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,故答案为:ClO-+Cl-+2H+═Cl2↑+H2O。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.在1L 0.1mol/L碳酸钠溶液中,阴离子总数为0.1NA
B.1mol铁与足量的氯气反应,失去电子数为2NA
C.31g白磷分子中,含有的共价单键数目是NA
D.1mol Na2O2与足量CO2反应,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成n mol A2,同时消耗2n mol AB
B. 容器内,3种气体AB、A2、B2共存
C. 容器中各组分的体积分数不随时间变化
D. AB的消耗速率等于A2的消耗速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。下列有关说法正确的是( )
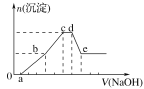
A.在0~a段加入的NaOH溶液与NH4Cl反应
B.在b~c段加入NaOH溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓
C.在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-===AlO2-+2H2O
D.在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温时CuSO4的水溶液呈____(填“酸”“中”或“碱”)性,原因是(用离子方程式表示_________。
(2)在实验室配制FeCl3溶液时,常将FeCl3固体先溶于较浓的______(填物成名称)中,然后用蒸馏水稀释到所需的浓度,以_________(填“促进”或“抑制”)其水解。
(3)把A1C13溶液蒸干、灼烧,最后得到的主要固体产物是____(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应3B(g) ![]() C(g)+D(g)的说法不正确的是( )
C(g)+D(g)的说法不正确的是( )
A.某时刻测得v正(B)=v逆(B),说明反应达到了化学平衡状态
B.反应达到化学平衡后,反应物和生成物的浓度不再改变
C.反应达到平衡后,反应就停止了
D.上述反应中,B不可能全部转化为C和D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究表明,某品牌打火机中的液体燃料为液态的烃甲,其分子中碳、氢原子个数比为2:5,此有机物的分子式为________________,该有机物同系物的通式为_____________,甲可能的结构简式为_____________、_______________;碳、氢个数比为1:2的烃乙可通过与![]() 加成得到甲,则乙为__________烃,写出乙可能的所有结构简式:____________________。
加成得到甲,则乙为__________烃,写出乙可能的所有结构简式:____________________。
(2)奥运火炬中使用的燃料为混合物,其主要成分为丙烷,请写出丙烷完全燃烧的化学方程式:____________。现将等质量的天然气和丙烷分别与足量氧气反应,则前者与后者消耗氧气的质量之比为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:

填写下列空白:
(1)甲中不含氧原子的官能团是___;下列试剂能与甲反应而褪色的是___(填字母)。
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:____。
(3)已知:C2H5Br+NaOH![]() CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
淀粉![]() A
A![]() B(C2H5OH)
B(C2H5OH)![]() C(C2H4)
C(C2H4)![]() D(C2H4Br2)
D(C2H4Br2)![]() 乙
乙
①A的分子式是____,试剂X可以是_____。
②写出由D生成乙化学方程式:_______。
(4)已知:
 +HCl(-R为羟基)
+HCl(-R为羟基)
 +H2
+H2
根据已有知识并结合相关信息,写出以苯、乙烯、氯化氢为原料制备丙的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3______。
CH3COOCH2CH3______。
(5)写出丙在引发剂的条件下生成高分子化合物的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com