
| A. | ②⑥ | B. | ③④⑤⑥ | C. | ③④⑥ | D. | ①② |
分析 部分电离的电解质是弱电解质,要证明醋酸是弱电解质,只要证明醋酸部分电离即可,可以根据一定浓度醋酸溶液的pH值、强酸制取弱酸、醋酸钠溶液的pH值等方面判断.
解答 解:①醋酸与水能以任意比互溶,说明醋酸溶解性强,但不能说明醋酸部分电离,则不能证明醋酸是弱电解质,故错误;
②醋酸溶液能导电,说明醋酸是电解质,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故错误;
③醋酸溶液中存在醋酸分子,说明醋酸在水溶液中存在电离平衡,部分电离,为弱电解质,故正确;
④0.1mol•L-1醋酸溶液的pH比0.1mol•L-1盐酸的pH大,说明醋酸部分电离,为弱电解质,故正确;
⑤醋酸能和碳酸钙反应放出CO2,说明醋酸酸性大于碳酸,因为碳酸是弱酸,所以不能说明醋酸是强酸还是弱酸,故错误;
⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢,说明醋酸中氢离子浓度小于盐酸,HCl是强电解质,则醋酸是弱电解质,故正确;
故选C.
点评 本题考查弱电解质判断,为高频考点,侧重考查学生分析判断能力,明确弱电解质特点(部分电离)是解本题关键,电解质强弱与其溶解性强弱、溶液导电性强弱无关,易错选项是①.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
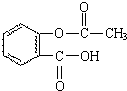 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
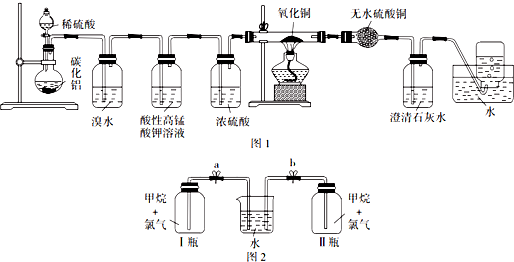
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
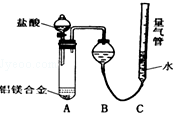 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
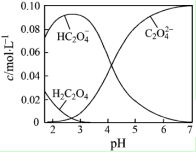 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | pH=7的溶液中:c(Na+)>2c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
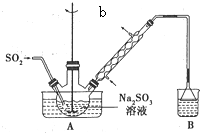 次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:
次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).
,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com