
 右图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题。
右图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题。
(1)B中加入的试剂是________,作用是___________________。
(2)C中加入的试剂是__________,作用是_________________。
(3)D中加入的试剂是________,作用是____________________________________。
(4)实验时,C中应观察到的现象是_________________________________________。
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
化学反应A2+B2=2AB的能量变化如图所示。下列说法正确的是( )
A.该反应是吸热反应
B.断裂1molA-A键和1mol B-B键放出xkJ能量
C.断裂2molA-B键需要吸收ykJ能量
D.2molAB的总能量高于1mol A2和1mol B2的总能量

查看答案和解析>>
科目:高中化学 来源: 题型:
单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室用粗硅制备四氯化硅的装置示意图。

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 。
(2)装置A中仪器g的名称是 ;装置C中的试剂是 ;
(3)从安全角度考虑,若将装置E中通入h瓶的粗玻璃导气管换成细玻璃导气管,可能带来的后果是 。
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(5)为分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+ 5Fe3++Mn2++4H2O
5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂? (填“是”或“否”),判断达到滴定终点的现象是 。
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100 mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/L KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液
褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
查看答案和解析>>
科目:高中化学 来源: 题型:
用下面的方案进行某些离子的检验,其中方案设计最严密的是 ( )
A.检验试液中的SO :试液
:试液 无沉淀
无沉淀 白色沉淀
白色沉淀
B.检验试液中的SO :试液
:试液 无沉淀
无沉淀 白色沉淀
白色沉淀
C.检验试液中的I-:试液 深黄色溶液
深黄色溶液 深黄色溶液
深黄色溶液
D.检验试液中的CO :试液
:试液 白色沉淀
白色沉淀 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)
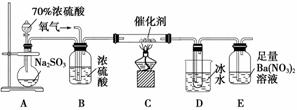
 ①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:_______________________。
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:_______________________。
②实验过程中,需要通入氧气。试写出一个用如右图所示装置制取氧气的化学方程式:____________________________________________。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是____________________________________________________________________。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
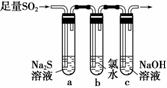
①能说明二氧化硫具有氧化性的实验现象为_________________________________
________________________________________________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使KMnO4酸性溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是( )
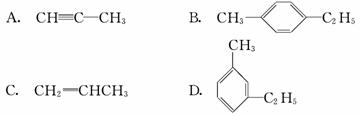
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com