
【题目】下列提纯物质方法正确的是( )
A.用BaCl2溶液除去HNO3溶液中的少量H2SO4
B.用NaOH溶液除去铝粉中的少量铁粉
C.用氯水除去FeCl2溶液中的少量FeCl3
D.用加热法除去NaCl固体中的少量NH4Cl
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
B | 苯(Br2) | NaOH溶液 | 过滤 |
C | C2H5OH(乙酸) | 新制生石灰 | 蒸馏 |
D | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
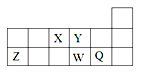
A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,错误的是( )
A.油脂和蔗糖都属于高分子化合物
B.油脂在碱性条件下水解可以用于制肥皂
C.蛋白质水解最终能得到氨基酸
D.淀粉、纤维素在一定条件下水解均可得到葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是生产羰基化学品的基本原料,对于以水煤气为原料提取CO的工艺,如果氢气
未能充分利用,则提高了CO生产成本,所以在煤化工中常需研究不同温度下的平衡常数、投料比及热值问题.反应CO(g)+H2O (g)H2(g)+CO2(g)的平衡常数随温度的变化如表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | a |
(1)上述反应的逆反应是(填“放热”或“吸热”)反应.
(2)已知在一定温度下:C(s)+CO2(g)2CO(g) K
C(s)+H2O (g)H2(g)+CO(g) K1
CO(g)+H2O (g)H2(g)+CO2(g) K2
则K、K1、K2、之间的关系是 .
(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0molH2O(g),保持温度不变进行反应:CO(g)+H2O (g)H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%.
①0~4min内,CO2的平均反应速率为molL﹣1min﹣1 , 800℃时a= .
②800℃时四个不同容器中发生上述反应,测得各物质的浓度(molL﹣1)如表,其中达到平衡状态的是(填字母).
A | B | C | D | |
c(CO2) | 3 | 1 | 0.8 | 1 |
c(H2) | 2 | 1 | 0.8 | 1 |
c(CO) | 1 | 2 | 3 | 0.5 |
c(H2O) | 2 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
实验Ⅰ
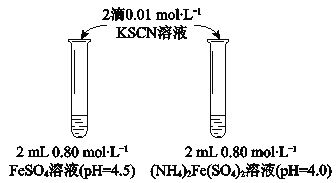
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因____________。
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(4)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。
由实验III,乙同学可得出的结论是___________,原因是__________________。
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____________。
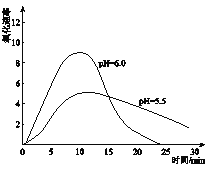
(6)综合以上实验,增强Fe2+稳定性的措施有_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com