
【题目】化学在生产和日常生活中有着重要的应用。下列说法中错误的是
A.青铜是我国使用最早的合金,也是目前使用最广泛的合金
B.明矾水解形成的胶体能吸附水中悬浮物,可用于水的净化
C.燃放烟花是利用了某些金属元素的焰色反应
D.铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的Ksp 为2.0×10-5,将适量Ag2SO4固体溶于水中配成100 mL饱和溶液,该过程中Ag+和SO42-浓度随时间变化关系如图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
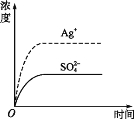
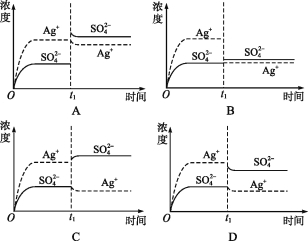
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①该反应的熵变△S0 ( 填:“<,>,=”).该反应在(填:高温或低温)条件下能自发进行.
②要提高CO的转化率,可以采取的措施是(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率AC(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数AC,由状态B到状态A,可采用的方法(填“升温”或“降温”). 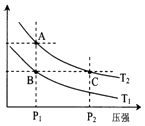
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,正确的是( )
A.浓硝酸和稀硝酸都具有强氧化性
B.铜和稀硝酸的反应属于置换反应
C.在铜与浓硝酸的反应中,硝酸只体现氧化性,没有体现酸性
D.可用铝或铁制容器盛装稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:

(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为_____________(选填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入______________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为____________。
(4)图中长玻璃导管的作用为__________________________。
(5)写出该反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.
(1)铁炭混合物在水溶液中可形成许多微电池.将含有Cr2O72﹣的酸性废水通过铁炭混合物,在微电池正极上Cr2O72﹣转化为Cr3+ , 其电极反应式为 .
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图1所示. 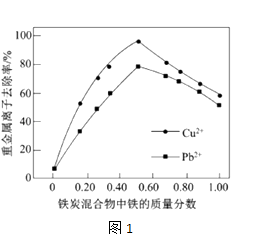
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是 .
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是 .
(3)纳米铁粉可用于处理地下水中的污染物. ①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为 .
②纳米铁粉与水中NO3﹣反应的离子方程式为4Fe+NO3﹣+10H+=4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是 .
③相同条件下,纳米铁粉去除不同水样中NO3﹣的速率有较大差异(见图2),产生该差异的可能原因是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)BiCl3的水解产物中有BiOCl生成。
①写出BiCl3水解反应的方程式:_________________________。
②医药上将BiOCl称为次氯酸铋,该名称____________(填“正确”或“不正确”)。
③如何配制BiCl3溶液?_________________________________。
(2)将pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
①若生成的盐中只有一种离子水解,该离子水解的离子方程式为_____________________。
②简述该混合液呈碱性的原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律分析下面的推断正确的是
A. 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂
B. 砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀
C. 硫酸锶难溶于水,但易溶于盐酸
D. 硒化氢是无色、有毒、比硫化氢稳定的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 滴入稀HNO3,同时用pH试纸测定至溶液呈中性 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaCl | CaCO3 | 溶解、过滤、蒸发、结晶 |
A. ①②③ B. ②③④ C. ①③④ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com