
【题目】光电池是发展性能源。一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl (s) ![]() Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-=Cl- (aq),若将光源移除,电池会立即恢复至初始状态。下列说法不正确的是( )
Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-=Cl- (aq),若将光源移除,电池会立即恢复至初始状态。下列说法不正确的是( )

A. 光照时,电流由X流向Y
B. 光照时,Pt电极发生的反应为:2Cl-+2e-=Cl2↑
C. 光照时,Cl-向Pt电极移动
D. 光照时,电池总反应为:AgCl(s)+Cu+(aq)![]() Ag(s)+Cu2+(aq)+Cl-(aq)
Ag(s)+Cu2+(aq)+Cl-(aq)
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将固体X和气体Y各0.16 mol充入2L密闭容器中,发生反应:X(s)+Y(g)![]() 2 Z(g),一段时间后达到平衡。反应过程中测定的数据如下表:
2 Z(g),一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )。
A. 反应0~2 min内Z的平均速率v(Z) =0.04 molL﹣1min﹣1
B. 容器内压强保持不变时反应达到平衡
C. 该温度下,增加X的量,正反应速率加快
D. 降低Z 的浓度,一段时间后,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况),最主要的原因是_____________________;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:___________。
(2)ZnFe2Ox是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2Ox和用于除去废气的转化关系为ZnFe2O4![]() ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为________。请写出 ZnFe2Ox与NO2反应的化学方程式:_________________________(x用前一问求出的具体值)。
ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为________。请写出 ZnFe2Ox与NO2反应的化学方程式:_________________________(x用前一问求出的具体值)。
(3)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以 FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,该反应还生成一种可燃性气体,则反应的化学方程式为___________________________。
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开)工作原理为FePO4+Li![]() LiFePO4。则放电时正极上的电极反应式为___________________________________。
LiFePO4。则放电时正极上的电极反应式为___________________________________。
(4)已知25 ℃时Ksp[Fe(OH3)]=4.0×10-38,此温度下若在实验室中配制5 mol·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入______ mL 2 mol·L-1的盐酸(忽略加入盐酸时溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2 +3O2![]() 2Fe2O3 +8FeCl3。某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究。回答下列问题:
2Fe2O3 +8FeCl3。某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究。回答下列问题:


(1)装置的合理连接顺序为A、 、D,其中E装置U形管左边设计为粗导管的目的是 。
(2)A装置中发生反应的化学方程式为 。
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为 。
(4)待B中充分反应后,停止加热后,还需持续通氧气至 。
(5)设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱: 。
②测定装置B的残留固体中铁元素的质量分数: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
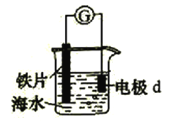
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+ 2H2O + 4e = 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++ 2e = H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于容积为2 L的密闭容器中,发生4A(g)+B(g)=2C(g)。反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol。则:用反应物A表示该反应的速率应为
A.1.5 mol·L-1·min-1B.0.75 mol·L-1·min-1
C.0.05 mol·L-1·s-1D.0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 生活中可以使用明矾对饮用水进行消毒、杀菌、除杂
B. 雾、有色玻璃、葡萄糖溶液中分散质的粒子直径大小均在1~100 nm之间
C. 过氧化钠能与二氧化碳反应产生氧气,可用于高空飞行或潜水的供氧剂
D. 煤的干馏是化学变化,煤的气化和液化是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律.
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色.在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl═NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性.现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:

(1)酸性:HNO3>H2CO3>H2SiO3
A、B、C中装试剂分别为_______;C中实验现象为______________________;
写出C中发生反应的离子方程式____________________________.
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性.则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂_______,C中现象_______________,写出B中反应的离子方程式___________________________.
(3)如果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察现象是C中产生淡黄色沉淀,写出化学方程式______;证明氯的非金属性比硫的非金属性______(填“强”或“弱”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25.00ml碱式滴定管中盛有溶液,液面恰好在20.00ml刻度处,现将滴定管中全部溶液放出,流入量筒内,所得溶液体积为( )
A. 5mL B. 20mL C. 大于5mL D. 小于5mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com