
已知氨气和氯气混合可发生下列反应: 2NH3+3Cl2 → 6HCl+N2,NH3+HCl → NH4Cl。
常温常压下,取总物质的量为12mol的氯气和氨气的混合气体,完全反应后,气体总物质的量保持不变。做54、55题
54.反应前氯气和氨气的物质的量之比为______________ (要求解题过程)
55. 反应后生成的氧化产物的质量为_________________(要求解题过程)
某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
56.由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生CO2_________mL(标准状况)。(要求解题过程)
57.另取3.32g天然碱样品于300℃加热分解至完全(300℃时NaCO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式(要求解题过程)。
58.由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为 _______2.5
mol/L
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列有机物的命名正确的是( )
A. 3,3-二甲基-4-乙基戊烷 B. 3,3,4-三甲基-1-己烯
C. 3,4,4-三甲基己烷 D. 2,3,3-三甲基-2-庚烯
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图装置进行实验,并回答下列问题
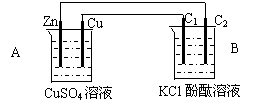 |
⑴锌极为__________极,电极反应式为_________________________
石墨棒C1为______极,电极反应式为________________________
石墨棒C2附近发生的实验现象为_______________________________
⑶当C2极析出224mL气体(标准状态)时,锌的质量减少_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
研究发现铜具有独特的杀菌功能,能较好地抑制病菌的生长。工业上铜冶炼大致可分为:
①富集:将硫化物矿石进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2→Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃主要的反应为:2Cu2S+3O2→2Cu2O+2SO2;2Cu2O+Cu2S→6Cu+SO2↑;
④电解精炼,在阴极得到精铜。
下列说法不正确的是
A.上述生产过程中的尾气可以通入氨水中,生产氮肥
B.电解精炼时,粗铜应与外电源的正极相连
C.反应2Cu2O+Cu2S→6Cu+SO2↑中的Cu2O是氧化剂
D.每生产6mol Cu,理论上需消耗11mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和氮的许多化合物在工农业生产和生活中有重要的作用。
28、工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为
29、以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)→NH2CO2 NH4(s) +l59.5 kJ·mol-1
②NH2CO2NH4(s) →CO(NH2)2(s)+H2O(g) -116.5 kJ·mol-1
③H2O(1) →H2O(g) -44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
30、以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
31、用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ====N2(g)+CO2(g)+Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填 “>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是
A.铜电极附近观察到黄绿色气体
B.石墨电极附近溶液呈红色
C.溶液中的Na+向石墨电极移动
D.铜电极上发生还原反应


查看答案和解析>>
科目:高中化学 来源: 题型:
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2 (该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+=== 2Cr3++3I2+7H2O 2S2O32-+I2===S4O62-+2I-
查看答案和解析>>
科目:高中化学 来源: 题型:
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是
| 化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | C2H5OH | FeCl3 |
| W | MgO | Al2O3 | C2H5ONa | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知氢气的燃烧热为285.8 kJ/mol,则H2(g)+1/2O2(g)===H2O(l) ΔH= ;
(2)用离子方程式来表示强酸和强碱的中和热(焓变的数值为57.3):
H+(aq)+ === ,ΔH= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com