
【题目】下列说法正确的是
A. 在实验室中可以用己烯通萃萃取提取溴水中的溴单质
B. 在一定条件下乙烯可被氧化成乙醇,乙醇可以被氯化为乙酸
C. lmol葡萄糖能水解生成2molCH3CH2OH和2molC02
D. 乙烯使酸性高锰酸钟溶液褪色与乙烯使漠水褪色的原理不同
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】从牛至精油中提取的三种活性成分的结构简式如下图所示,下列说法正确的是( )
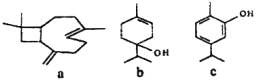
A. a、b、c均能使酸性KMnO4溶液褪色
B. a、b中均含有2个手性碳原子(手性碳原子指连有四个不同基团的碳原子)
C. b、c均能发生加成反应、还原反应、取代反应、消去反应
D. c分子中所有碳原子可以处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于工业生产说法错误的是( )
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
B.在硫酸工业、合成氨工业中,皆采用循环操作提高原料利用率
C.在侯氏制碱工业中,二氧化碳可以循环利用
D.硫酸工业中,用水来吸收三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L 硫酸溶液进行中和热的测定,实验装置如图所示。

(1)已知中和热的理论值△H= -57.3kJ·mol-1,写出NaOH溶液和稀硫酸反应的中和热的热化学方程式:_______________。
(2)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
实验组 | 起始温度t1/℃ | 终止温度 t2/℃ | |
H2SO4 | NaOH | ||
1 | 26.2 | 26.0 | 30.1 |
2 | 27.0 | 27.4 | 33.1 |
3 | 26.4 | 26.2 | 30.5 |
①中和热△H=____________(取小数点后一位)。[已知:比热容c=4.18J·(g·℃)-1]
②上述实验数值结果与-57.3 kJ·mol-1有偏差,产生偏差的原因可能是______(填字母)。
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.量取NaOH溶液的体积时仰视读数
d.用温度计测定NaOH溶液起始温度后直接测量硫酸的温度
(3)若取100mL0.50mol/L NaOH溶液和50mL0.50mol/L 硫酸进行中和热的测定,其它实验条件相同,则所测得中和热的数值______(填“偏大”、“偏小”或“不变”)。
(4)已知一元弱酸HA(aq)与NaOH(aq)反应生成1mol H2O(l)时的△H= -23.1 kJ·mol-1,依据中和热的理论值,则HA(aq)![]() H+(aq)+A-(aq)的△H=____________。
H+(aq)+A-(aq)的△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的实验方法不正确的是 ( )。
A.除去Na2CO3固体中的少量NaHCO3 , 置于坩埚中加热
B.除去SO3中的少量SO2 , 可通入适量的O2
C.除去合成氨中生产的NH3中的N2、H2 , 可采用降温的方法
D.纯碱生产中所得的NH4Cl和NaHCO3混合物,可采用结晶过滤的方法分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁.用作合金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂,为了增加V2O5的利用率,我们从废钒催化剂(主要成分V2O5,VOSO4,K2SO4,SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:

部分含钒物质在水中的溶解性如下,回答下列问题:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解牲 | 可溶 | 难溶 | 难溶 | 易溶 |
(l)①中废渣的主要成分是____;①中V2O5发生反应的离子方程式为_____________。
(2)②,③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2nHA(有机层)![]() 2RA(有机层)+nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是________________;实验室进行萃取操作主要使用的玻璃仪器为________________。
2RA(有机层)+nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是________________;实验室进行萃取操作主要使用的玻璃仪器为________________。
(3)实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取l00g该废钒催化剂按工业生产的步骤进行实验,当加入100 mL0.1mol/L的KC1O3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是____(己知V2O5的相对分子质量为182)。
(4) 25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 | 89.3 |
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为_________;若钒沉淀率为93.1%时不产生Fe( OH)3沉淀,则此时溶液中c(Fe3+)=_________。(已知:25℃时k[Fe(OH)3]=2.6×l0-39.)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、A13+、AlO2-、SiO32-、CO32-、SO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是
A. 气体甲一定是纯净物 B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO2-、SiO32-一定存在于溶液X中 D. CO32-和SO42-一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
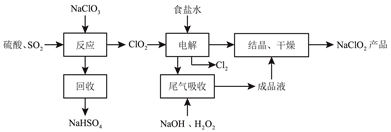
已知:亚氯酸钠在温度高于80℃时分解。下列说法不正确的是( )
A. “反应”步骤中生成ClO2的化学方程式是:2NaClO3+SO2+H2SO4===2NaHSO4+2ClO2
B. 电解食盐水的阴极产物是NaOH和H2
C. ClO2尾气吸收时氧化剂和还原剂的物质的量之比为1:1
D. 从NaClO2溶液中得到NaClO2产品,应采用减压蒸发的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com