
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,8g甲醇(CH3OH)燃烧生成CO2和液态水时放热176kJ,32g甲醇燃烧生成CO2和液态水时放热176kJ×$\frac{32}{8}$=704kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热704KJ,根据燃烧热的概念分析即可解答;
(2)反应热=反应物总键能-生成物总键能,据此计算;
(3)分析图象中物质能量变化可知AB反应物能量低于生成物CD,反应是吸热反应;催化剂改变反应速率,不改变化学平衡,反应热不变;
(4)首先写出FeO(s)被CO还原成Fe和CO2的热化学方程式CO(g)+FeO(s)=Fe(g)+CO2(g)△H,利用盖斯定律①×3-(③×2+②)可得到该化学方程式.
解答 解:(1)1mol甲醇完全燃烧生成二氧化碳和液态水放热704KJ,燃烧热热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-704kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O (l)△H=-704 KJ/mol;
(2)436kJ/mol+243kJ/mol-2E(H-Cl)=-185kJ/mol,解得E(H-Cl)=432KJ/mol,故答案为:432 kJ/mol;
(3)分析图象中物质能量变化可知AB反应物能量低于生成物CD,反应是吸热反应,A(g)+B(g)?C(g)+D(g)过程中的能量变化为吸热,其它条件不变在反应体系中加入催化剂,改变反应速率,不改变化学平衡,反应热不变所以对反应热无影响,
故答案为:吸热,不变;
(4)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol
依据盖斯定律①×3-(③×2+②)得到:
6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66kJ/mol;
得到热化学方程式为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol,
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,化学反应能量变化的分析判断,影响化学平衡的因素分析,注意催化剂改变反应速率不改变化学平衡,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溴的煤油溶液里加入苯震荡 | B. | 向溴水里加入酒精后震荡 | ||
| C. | 向碘的四氯化碳的溶液里加水震荡 | D. | 向碘水里加入四氯化碳后震荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 网状结构的聚丙烯酸钠是高吸水性树脂,可用于制造“尿不湿” | |
| B. | 光导纤维应避免在强碱性环境中使用 | |
| C. | 利用超临界C02流体作为萃取溶剂符合绿色化学 | |
| D. | 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 溶液体积(mL) | 反应后溶液的pH | |
| HA | KOH | ||
| ① | 10 | 10 | |
| ② | 10 | a | 7 |
| A. | 实验①所得的混合溶液中:c(K+)>c(A-)>c(H+)>c(OH-) | |
| B. | 实验①所得的混合溶液中:c(OH-)+c(A-)=c(K+)+c(H+) | |
| C. | 实验②所得的混合溶液中:c(A-)+c(HA)=0.1mol•L-1 | |
| D. | 实验②所得的混合溶液中:(K+)>c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ ClO- SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
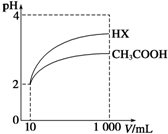 体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | NaOH溶液可以用氨水来代替 | |
| B. | 溶液a中含有Al3+、K+、Cl-、Na+、OH- | |
| C. | 溶液b中只含有NaCl | |
| D. | 向溶液a中滴加盐酸需控制溶液的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com