
【题目】氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
一定条件下,在2L密闭容器内,反应2NO2![]() N2O4,n(NO2)随时间变化如表:
N2O4,n(NO2)随时间变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均反应速率___。在第5s时,NO2的转化率为___。根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
【答案】0.0075mol·L-1·s-1 87.5% 随着反应的进行,二氧化氮的物质的量浓度减小
【解析】
根据v=c/t,α=变化量/起始量×100%进行计算;根据影响反应速率的因素进行分析。
NO2浓度的变化量=(0.04-0.01)mol/2L=0.015mol/L;NO2在0~2s内该反应的平均反应速率=0.015mol/L÷2s=0.0075mol·L-1·s-1;根据图表信息可知,在第5s时,NO2的转化率为(0.04-0.005)mol/0.04×100%=87.5%;随着反应的进行,二氧化氮的物质的量浓度减小,反应速率减慢;
故答案是:0.0075mol·L-1·s-1 ;87.5%;随着反应的进行,二氧化氮的物质的量浓度减小。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油![]() 即在汽油中添加一定量的甲醇
即在汽油中添加一定量的甲醇![]() ,根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体
,根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体![]() 一氧化碳
一氧化碳![]() 排放将近100万吨。甲醇常利用煤气化过程中生成的CO和
排放将近100万吨。甲醇常利用煤气化过程中生成的CO和![]() 来制备:CO+2H2
来制备:CO+2H2![]() CH3OH,
CH3OH,

请根据图示回答下列问题:
(1)关于该反应的下列说法中,正确的是______![]() 填字母
填字母![]() :
:
A.![]() ,
,![]()
![]() ,
,![]() C.
C.![]() ,
,![]()
![]() ,
,![]()
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和![]() ,净测得CO和
,净测得CO和![]() 的浓度随时间变化如图所示,从反应开始到平衡,CO的平均反应速率υ(CO)=______,该反应的平衡常数
的浓度随时间变化如图所示,从反应开始到平衡,CO的平均反应速率υ(CO)=______,该反应的平衡常数![]() ______。
______。
(3)判断该可逆反应达到化学平衡状态的标志是______(填字母)。
a.υ生成(CH3OH)=υ消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
e. 混合气体的压强不再改变
(4)恒容条件下,达到平衡后,下列措施中能使![]() 增大的有______。
增大的有______。
A.升高温度 B.充入He气 C.再充入1molCO和![]() D.使用催化剂
D.使用催化剂
(5)若在一恒容的密闭容器中充入1molCO和![]() ,达到平衡时测的混合气体的压强是同温同压下起始的0.6倍(此过程三种物质均处于气态)则平衡时混合气体的平均摩尔质量
,达到平衡时测的混合气体的压强是同温同压下起始的0.6倍(此过程三种物质均处于气态)则平衡时混合气体的平均摩尔质量![]() ______
______![]() 。(结果保留3位有效数字)
。(结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 依据铝热反应原理,能发生反应2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
B. 在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32-、Cl-一定能够大量共存
C. 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D. 氯化铝溶液中加入过量氨水反应实质是:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温常压下,32 g氧气所含的原子数为NA
B.标准状况下,22.4 L 四氯化碳的分子数为NA
C.0℃,101 kPa下,44.8 L氮气所含有的分子数为2NA
D.常温常压下,1 mol氦气含有的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,主要实验步骤如下
,主要实验步骤如下

步骤I、如图所示装置,将![]() 通入
通入![]() 中的软锰矿浆液中
中的软锰矿浆液中![]() 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器![]() 中加入适量纯净的
中加入适量纯净的![]() ,最后加入适量
,最后加入适量![]() 沉铅,
沉铅,
步骤III、过滤得![]() 溶液
溶液
(1)仪器R的名称是_______。
(2)装置![]() 用于制取
用于制取![]() ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置![]() 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置![]() 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净![]() 的目的是_______________,用
的目的是_______________,用![]() 调节溶液
调节溶液![]() 时,需调节溶液
时,需调节溶液![]() 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的![]() 如下表)
如下表)
金属离子 |
|
|
|
|
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化![]() 浊液可制备
浊液可制备![]() ,主要副产物为
,主要副产物为![]() ;反应温度和溶液
;反应温度和溶液![]() 对产品中
对产品中![]() 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过![]() 时,
时,![]() 的产率开始降低,
的产率开始降低,![]() 是白色沉淀,
是白色沉淀,![]() 呈黑色;
呈黑色;![]() 、
、![]() 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到![]() 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的![]() 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
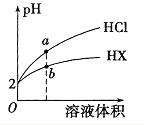
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10 月9 日诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。PC15、LiFePO4聚乙二醇、LiPF6、LiAsF6等可作制锂离子电池的材料。回答下列问题:
(l)Fe 的价层电子排布式为______________。Li、Fe、Cl、P 四种元素的第一电离能由大到小的顺序为___________________。
(2) PC13中心原子P 杂化类型是___________。将氨水和FeCl3 溶液混合后过滤出沉淀,再将沉淀溶入KOH 饱和溶液中,得到6 – 羟基配合物溶液,该配合物的化学式为_____。
(3)下列物质沸点最高的是_____________。
.A.正戊烷[ CH3 ( CH2)3CH3 ] B. l-丙醇 ( CH3 CH2 CH2OH)
C.乙二醇( HOCH2 CH2OH) . D. 丙醛( CH3CH2 CHO)
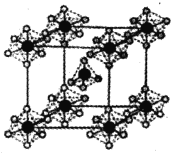
(4)熔融的PC15冷却后变为白色的离子晶体,晶体的晶胞如图所示,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,写出阴、阳离子的化学式 __________;正四面体形阳离子中键角大于PC13 的键角原因为______________。
(5)电池工作时,Li+ 沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图所示(X=P、As)。
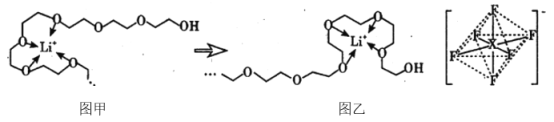
相同条件,Li+ 在LiAsF6 中比在LiPF6 中迁移较快,原因是 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】管道工人曾经用浓氨水检查氯气管道是否漏气,发生反应:8NH3+3Cl2=6NH4Cl+N2。下列叙述正确的是( )
A.NH3的电子式为![]()
B.每转移3NA电子时,消耗Cl2的体积为33.6L
C.该检验过程有共价键、离子键的断裂与生成
D.用该方法检验管道泄漏处会产生白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为________。
的中子数为________。
已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________。
(2)氮和磷氢化物性质的比较:热稳定性:NH3________PH3(填“>”或“<”)。沸点:N2H4________P2H4(填“>”或“<”),判断依据是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com