
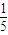 ��100-x��ml����ֻ������4NH3+5O2��4NO+6H2O�����������ɣ�������������4��5��Ӧ����ǡ�÷�����ӦNH3+2O2=HNO3+H2O����ȫ���������ᣬ������������1��2��Ӧ��Ȼ�������ڲ�ͬ��Χ�ڵķ�Ӧ�Ȳ�ͬ�����ﲻͬ������ó���
��100-x��ml����ֻ������4NH3+5O2��4NO+6H2O�����������ɣ�������������4��5��Ӧ����ǡ�÷�����ӦNH3+2O2=HNO3+H2O����ȫ���������ᣬ������������1��2��Ӧ��Ȼ�������ڲ�ͬ��Χ�ڵķ�Ӧ�Ȳ�ͬ�����ﲻͬ������ó���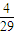 =0.14���ʴ�Ϊ��0.14��
=0.14���ʴ�Ϊ��0.14��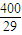 ��
��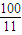 ��
��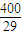 ʱֻ����4NH3+5O2��4NO+6H2O�����������ɣ�
ʱֻ����4NH3+5O2��4NO+6H2O�����������ɣ�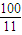 ������ȫ���������
������ȫ���������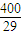 ��x��
��x��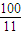 ʱ��������Ӧ4NH3+5O2��4NO+6H2O��ʣ��������ٷ�����Ӧ4NO+3O2+2H2O��4HNO3�����ݷ�Ӧ4NH3+5O2��4NO+6H2O���xmolNH3��Ҫ����
ʱ��������Ӧ4NH3+5O2��4NO+6H2O��ʣ��������ٷ�����Ӧ4NO+3O2+2H2O��4HNO3�����ݷ�Ӧ4NH3+5O2��4NO+6H2O���xmolNH3��Ҫ���� x��ʣ������0.2×��100-x��-
x��ʣ������0.2×��100-x��- x�����ݷ�Ӧ4NO+3O2+2H2O��4HNO3��3O2��4HNO3���õ�3��4=[0.2×��100-x��-
x�����ݷ�Ӧ4NO+3O2+2H2O��4HNO3��3O2��4HNO3���õ�3��4=[0.2×��100-x��- x]��y������ã�y=
x]��y������ã�y=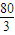 -
-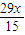 ��
��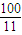 ��y=x
��y=x 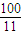 ��x��
��x��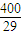 ��y=
��y=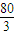 -
-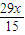 ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ���ð���������Ļ������һ�������������ᣬ�����ķ�Ӧ�ǣ�
�� 4NH3+5O2 ��4NO+6H2O
![]() �� 4NO+3O2+2H2O��4HNO3
�� 4NO+3O2+2H2O��4HNO3
��������������������Ϊ0.20�������������Ϊ0.80�������������ռ����㣺
��1��Ϊʹ����ǡ����ȫ����Ϊһ������������������Ļ�����а����������(��С����ʾ)Ϊ________(����2λС��)��
��2���ֽ�1 mol�İ�����12 mol�Ŀ�����Ϸ�Ӧ���ɵõ����� mol��
��3����������Һ�м��� mL 20%�����ᣨ�ܶ�Ϊ1.11g/mL�������ܵõ�69%��������Һ��
��4������100mol��ԭ���������к�����Ϊxmol����Ӧ�����ɵ�����ymol���ڵõ�����������£�д��x��y�Ĺ�ϵʽ����д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009���Ϻ����ɽ����߿���ѧģ���Ծ��������棩 ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com