
 (1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______.
(1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______.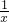 Sx、CO+
Sx、CO+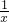 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+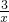 Sx.其中COS(羰基硫)分子的电子式为______.
Sx.其中COS(羰基硫)分子的电子式为______. ;
; ;
;

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
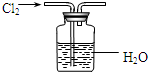 下列有关实验原理或实验操作正确的是
下列有关实验原理或实验操作正确的是查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com