
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示细胞鲜重,则A、B化合物依次是H2O、蛋白质
B. 若图2表示组成人体细胞的元素含量,则a、b、c依次是O、C、H
C. 地壳与活细胞中含量最多的元素都是a,因此说明生物界与非生物界具有统一性
D. 若图1表示细胞完全脱水后化合物的含量,则A化合物具有多样性,其中含的元素为C、H、O、N
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:
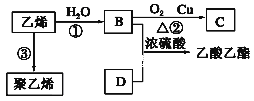
(1)C中含官能团名称_________;
(2)写出B与D反应的化学方程式____________________________;反应类型:________。
(3)写出反应③的化学方程式:_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是
①蛋壳能否溶于酸 ②白酒中是否含有甲醇 ③鉴别食盐和小苏打 ④检验自来水中是否含有氯离子
A. ①② B. ②④ C. ③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为苹果成熟期有机物质含量的变化图,请据图回答相关问题:

(1)图中五种有机物质最可能含有S元素的是_______,属于单糖的是___________。
(2)若在6-11月每个月采集苹果制备组织提取液,并用斐林试剂检测,则______月的苹果提取液______________色最深,说明该月还原糖含量最高。
(3)苹果中除了还原糖外,还有组成其细胞壁的多糖是_________,其单体为_________。
(4)苹果中还含有少量的脂质,属于细胞内良好储能物质的是_________,构成细胞膜重要成分的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了测定部分变质的Na2SO3样品的纯度,设计了如图实验,回答下列问题:

(1)写出A装置中玻璃仪器的名称:酒精灯__________________
(2)实验开始后,写出B中反应的离子方程式__________________
(3)E装置的作用是__________________
(4)按图2所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应.然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g,则样品中Na2SO3的纯度为__________________(精确到0.1%)
(5)在过滤沉淀时若滤液出现浑浊,则必须要重复操作,若该学生没有重复过滤,则测定的结果将__________________
(6)要使测定结果准确,第一:装置气密性必须良好;第二:应先点燃__________________处酒精灯(填装置字母).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用VSEPR模型和杂化轨道理论相关知识填表:
分子或离子 | 孤电子对数 | 杂化轨道数 | 中心原子杂化轨道类型 | 分子或离子的立体结构 |
NH3 | _____ | _____ | _____ | _____ |
BeCl2 | _____ | _____ | _____ | ______ |
SO3 | _____ | _____ | _____ | _____ |
SO42- | _____ | _____ | _____ | _____ |
NCl3 | _____ | _____ | _____ | _____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显_____价,A的电负性_______B的电负性(填“>”、“<”或“=”)。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(已知3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:_________________。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有________________个。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是______________。
(4)某配合物的分子结构如图所示,其分子内不含有__________(填序号)。

A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 零下10摄氏度液态水结冰属于自发过程,因为这是一个熵增的过程
B. 在化学平衡、电离平衡、水解平衡中,平衡常数都随温度的升高而增大
C. 升高温度和使用正催化剂都可降低反应活化能而使化学反应速率加快
D. 使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com