
已知4NH3+5O2=4NO+6H2O ,若反应速率分别用V(NH3)、 V(O2)、V(NO)、V(H2O)表示,则正确的关系是( )
A. V(NH3)=V(O2) B.
V(NH3)=V(O2) B.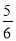 V(O2)=V(H2O)
V(O2)=V(H2O)
C.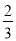 V(NH3)=V(H2O) D.
V(NH3)=V(H2O) D. V(O2)=V(NO)
V(O2)=V(NO)
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:实验题
废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O],流程设计如下:

已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)反应①的离子方程式是 。
(2)反应②中H2O2的作用是 。
(3)反应③的离子方程式是 。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+ (水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层)
2CeT3 (有机层)+ 6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是 。
(5)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期9月月考化学试卷(解析版) 题型:选择题
下列实验设计能完成或实验结论合理的是( )
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化
B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比 较
较
D.用浓硫酸吸收二氧化硫中混有少量SO3气体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:选择题
在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是( )
A.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
B.平衡时,N2O4的转化率为60%
C.平衡时,体系内NO2为0.04mol·L-1
D.在2s时,体系内压强为反应前的1.1倍
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:选择题
已知450℃时,2SO2(g)+O2(g) 2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是( )
2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是( )
A.Q2=Q1/2 B.Q2<Q1/2 C.Q2>Q1/2 D.不能确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上开学考试化学卷(解析版) 题型:推断题
甲、乙、丙、丁分别是Na2CO3溶液、AgNO3溶液、BaCl2溶液、盐酸中的一种,两两反应后产生的实验现象如下: 甲+乙→沉淀 ,甲+丙→沉淀 ,乙+丙→沉淀 ,丙+丁→沉淀 ,乙+丁→无色无味气体。回答下列问题:
(1)甲、乙、丙、丁依次是 、 、 、 。
(2)写出甲和乙、丙和丁、乙和丁反应的化学方程式 、 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上开学考试化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法中错误的是( )
A.4.6g金属钠变成Na+,失去的电子数为0.2NA
B.1.0L 1mol/L NaOH水溶液中含有的氧原子数为NA
C.17g NH3 所含的电子数为10NA
D.9.5g MgCl2 溶于水所得溶液中含Cl- 数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9月月考化学试卷(解析版) 题型:选择题
25℃、101KPa时,agNH3与bgCH4的体积相同,下列叙述不正确的是( )
A.NH3、CH4的分子数之比为1 : 1
B.NH3、CH4两种气体的密度之比为a: b
C.NH3、CH4的摩尔质量之比为17: 16
D.NH3、CH4的物质的量之比为a: b
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上第一次月考化学试卷(解析版) 题型:填空题
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出a kJ的热量,试写出表示甲烷燃烧热的热化学方程式: __;
(2)已知反应CH3—CH3(g)→ CH2===CH2(g)+H2(g),有关化学键的键能如下:
化学键 | C—H | C===C | C—C | H—H |
键能/kJ·mol-1 | 414.4 | 615.3 | 347.3 | 435.3[XK] |
通过计算得出该反应的反应热为 ;
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算25OC时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变:ΔH=_ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com