
【题目】将足量铁粉放入100 mL 0.1 mol·L-1的CuSO4溶液中,充分反应后析出的铜的质量为( )
A.32 g B.6.4 g C.0.64 g D.3.2 g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于人体细胞组成元素的叙述,正确的是
A. 细胞干重含量最多的元素是C
B. 活细胞中含量最多的是O,其次是H
C. 组成细胞的微量元素含量少、作用小
D. 细胞中最基本的元素是O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X+Y═M+N为放热反应,对该反应的说法正确是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、1.01×105 Pa下,反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJmol﹣1能自发进行的合理解释是( )
A.该反应是分解反应 B.该反应的熵增效应大于焓变效应
C.该反应是熵减反应 D.该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:

(1)酸式电池的电极反应:负极______________,正极________________;电池总反应:___________________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:负极______________,正极_____________;电池总反应:________________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )
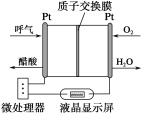
A.该电池的负极反应式为CH3CH2OH+3H2O-12e-===2CO2↑+12H+
B.该电池的正极反应式为O2+4e-+4H+===2H2O
C.电流由O2所在的铂电极经外电路流向另一电极
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体NH4I在密闭容器中受热分解发生下列反应:NH4I(s)![]() NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g)![]() H2(g)+I2(g)达到平衡时,c(HI)=4mol/L,c(I2)=0.5 mol/L,下列说法正确的是
H2(g)+I2(g)达到平衡时,c(HI)=4mol/L,c(I2)=0.5 mol/L,下列说法正确的是
A.平衡时HI的分解率20%
B.反应起始时固体NH4I是5 mol
C.平衡时,c (NH3)=4.5mol/L
D.平衡时HI的分解率10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g)ΔH>0
MgO(s)+CO2(g)+SO2(g)ΔH>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
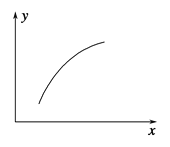
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_____________________。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=_____________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
C(s)+![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____________。
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图:

①请计算每生成1molNH3放出热量为:_________.
②若起始时向容器内放入1molN2和3molH2达平衡后N2的为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com