
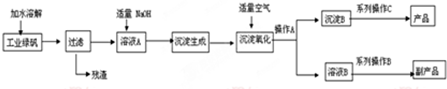
| 3.8×10-38 |
| (10-8)3 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A~D) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体压强不再发生变化 |
| B、混合气体质量不再发生变化 |
| C、反应中CO与H2的物质的量之比为1:1 |
| D、生成nmolCO的同时生成nmolH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
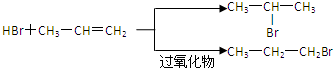
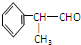 的物质,该物质是一种香料.
的物质,该物质是一种香料.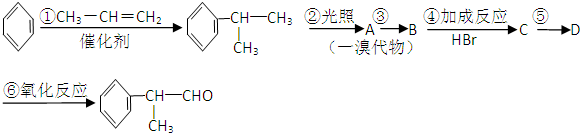
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X射线法、铜丝燃烧法、钠熔法、李比希燃烧法都是元素定性分析法 |
| B、日本福岛核电站释放的131I与137Cs,是两种不同的核素 |
| C、我国自行研制的“神七”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| D、氟氯烃是一种致冷剂,但它会破坏臭氧层,研究人员正在积极研发环保型的替代产品以减少氟氯烃的使用量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用 | 无明显现象 |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 | 有白色沉淀 |
| 步骤3:取少量步骤2得到的滤渣加入过量盐酸 | 滤渣不能完全溶解,说明酸雨中含有硫酸 |
| 步骤4:取适量步骤2得到的滤液, | |
| 步骤5:往B试管中加入 振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
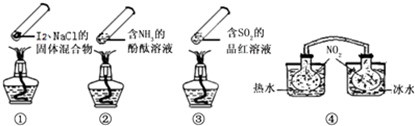
| A、加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 |
| B、加热时,②、③中的溶液均变红,冷却后又都变为无色 |
| C、④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D、四个“封管实验”中都有可逆反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 2.50 | 36.50 |
| 2 | 20.00 | 1.00 | 35.04 |
| 3 | 20.00 | 2.10 | 36.18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com