
| A. | 在漂白粉中滴入70%的硫酸,立即产生黄绿色气体,说明硫酸具有氧化性 | |
| B. | 久置的酚酞试液有白色沉淀(未变质),加入少量酒精,沉淀消失,再将该溶液滴入NaOH溶液,变红,说明酚酞易溶于酒精 | |
| C. | 在淀粉溶液中加入适量稀硫酸微热,向水解后的溶液中加入新制Cu(OH)2浊液并加热,无红色沉淀,说明淀粉未水解 | |
| D. | 检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液 |
分析 A.硫酸只起到酸性的作用;
B.酚酞难溶于水,易溶于酒精;
C.葡萄糖与氢氧化铜浊液的反应应在碱性条件下进行;
D.蔗糖水解生成葡萄糖,在碱性条件下可发生银镜反应.
解答 解:A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,实际上是氯离子和次氯酸根离子发生氧化还原反应生成氯气,硫酸在反应中只是中和碱,硫酸中各元素的化合价没有发生变化,所以不能说明硫酸具有氧化性,故A错误;
B.酚酞难溶于水,加入酒精后沉淀溶解可知说明酚酞易溶于酒精,故B正确;
C.淀粉在酸性条件下水解后应加入氢氧化钠调节溶液呈碱性,葡萄糖与氢氧化铜浊液的反应应在碱性条件下进行,故C错误;
D.蔗糖水解生成葡萄糖,在碱性条件下可发生银镜反应,故D正确.
故选BD.
点评 本题考查较为综合,涉及物质的检验与鉴别等操作,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握物质的性质异同以及实验的严密性、可行性的评价,难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
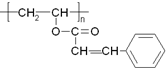 光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )| A. | 合成此高聚物的单体的化学式为C11H10O2 | |
| B. | 发生加成反应时1 mol该物质可消耗4molH2 | |
| C. | 该物质可稳定存在于碱性溶液中 | |
| D. | 该物质可经过缩聚反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维是一种能高质量传导光的玻璃纤维 | |
| B. | 光导纤维的抗干扰性能好,不发生电辐射,通讯质量高,能防窃听 | |
| C. | 高温结构陶瓷弥补了金属材料的弱点,但是硬度却远远低于金属材料 | |
| D. | 氮化硅陶瓷是一种重要的结构材料,具有超硬性,它能与氢氟酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 城市垃圾分类处理 | B. | 推广使用清洁能源 | ||
| C. | 过量使用化肥、农药 | D. | 推广使用无氟冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| B. | 常温常压下,2.3gNa+中含有的电子数为NA | |
| C. | 标准状况下,11.2L臭氧含有的氧原子数为NA | |
| D. | 0.1 mol•L-1Na2CO3溶液中含有的钠离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com